题目内容
【题目】下表是某化学兴趣小组探究影响化学反应速率的因素的实验数据。
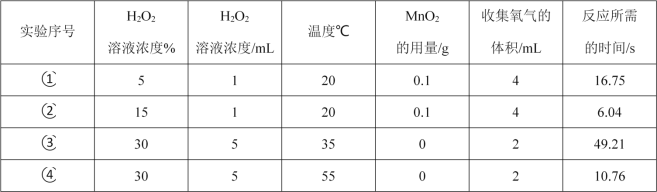
(1)通过实验①和②对比可知,化学反应速率与___有关;
(2)从实验___和___对比可知,化学反应速率与温度的关系是:___;
(3)该实验可得出的结论是___;
(4)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应的速率与微观粒子的碰撞概率有关。 从微观角度来看,“反应物浓度越大,化学反应速率越快”的原因是:反应物浓度越大,单位体积内粒子 数越___,粒子间碰撞的概率越大,化学反应速率越快。
【答案】反应物浓度; ③ ④ 温度越高,化学反应速率越快; 影响化学反应速率的因素有反应物的浓度、温度; 多
【解析】
(1)对比实验①和②,在其它因素相同的条件下,过氧化氢溶液浓度为15%时,反应放出氧气所消耗时间明显少于浓度为5%的溶液,因此,可归纳出:化学反应速率与反应物的浓度有关;
(2)对比实验③和④,在其它因素相同的条件下,过氧化氢溶液温度为55℃时,反应放出氧气所消耗时间明显少于温度为35℃的溶液,因此,可归纳出化学反应速率与温度的关系:温度越高,反应速率越快;
(3)根据对比实验①和②和对比实验③和④可知,该实验可得出的结论是影响化学反应速率的因素有反应物的浓度、温度;
(4)根据化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应的速率与微观粒子的碰撞概率有关。从微观角度来看,“反应物浓度越大,化学反应速率越快”的原因是:反应物浓度越大,单位体积内粒子数越多,粒子间碰撞的概率越大,化学反应速率越快。

【题目】定量和定性研究对于化学科学发展有重大作用,请回答下列问题。
(1)二氧化锰对过氧化氢的分解有催化作用,现将34g过氧化氢溶液于分液漏斗A中,向B中加入一定量的二氧化锰,活塞K保持打开。不同时间电子天平的读数如下表所示(不考虑H2O逸出):
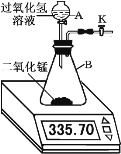
反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
装置 + 过氧化氢溶液 + 二氧化锰/g | 335.70 | 333.78 | 332.64 | 332.58 | 332.50 | 332.50 | 332.50 |
由题目可知产生氧气的质量为__________
根据上述氧气的量计算参加反应的过氧化氢的物质的量(根据化学方程式列式计算)________
(2)小明同学发现FeCl3溶液和CuSO4溶液对过氧化氢的分解也有催化作用,为比较相同浓度的FeCl3溶液和CuSO4溶液对过氧化氢分解的催化效果,他进行了如下探究:
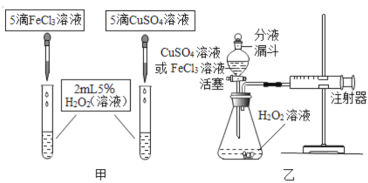
(定性探究)
如图甲,可通过观察_______来定性比较两者的催化效果。此时对比实验应控制的相同条件是____________。
(定量研究)
如图乙,要定量比较两者的催化效果,可测量生成等体积所需的_________;实验前要做的是___________。