题目内容
(2013?吉安模拟)请根据下图所示的实验过程和提供的数据,回答下列问题:
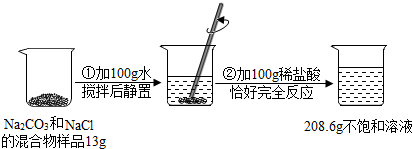
(1)生成二氧化碳的质量为
(2)计算出混合物样品中氯化钠的质量(写出计算过程).
(3)该实验实际测得的氯化钠质量往往会有偏差,其原因可能是

(1)生成二氧化碳的质量为
4.4g
4.4g
,稀盐酸的溶质质量分数为7.3%
7.3%
.(2)计算出混合物样品中氯化钠的质量(写出计算过程).
(3)该实验实际测得的氯化钠质量往往会有偏差,其原因可能是
二氧化碳部分溶于水
二氧化碳部分溶于水
.分析:(1)根据质量守恒定律反应前后减少的质量即为生成二氧化碳的质量,可以据此进行计算;
(2)根据反应生成的二氧化碳的质量结合反应的化学方程式可以计算出碳酸钠的质量,进而可以计算出氯化钠的质量;
(3)由于二氧化碳能够溶于水,所以实验过程会由于二氧化碳溶于水而使反应溶液的质量偏大,从而使二氧化碳的质量偏低,这样会造成结果的偏差,可以据此解答.
(2)根据反应生成的二氧化碳的质量结合反应的化学方程式可以计算出碳酸钠的质量,进而可以计算出氯化钠的质量;
(3)由于二氧化碳能够溶于水,所以实验过程会由于二氧化碳溶于水而使反应溶液的质量偏大,从而使二氧化碳的质量偏低,这样会造成结果的偏差,可以据此解答.
解答:解:(1)反应生成二氧化碳的质量为:13g+100g+100g-208.6g=4.4g,
设100g盐酸中含有氯化氢的质量为x,碳酸钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
y x 4.4g
=
=
解得:x=10.6g y=7.3g
所以盐酸中溶质的质量分数为:
×100%=7.3%
(2)氯化钠的质量为13g-10.6g=2.4g
答:混合物中氯化钠的质量为2.4g
(3)由于二氧化碳能够溶于水,所以实验过程会由于二氧化碳溶于水而使反应溶液的质量偏大,从而使二氧化碳的质量偏低,这样会造成结果的偏差.
故答案为:(1)4.4g;7.3%;
(2)2.4g;
(3)二氧化碳部分溶于水.
设100g盐酸中含有氯化氢的质量为x,碳酸钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
y x 4.4g
| 106 |
| y |
| 73. |
| x |
| 44 |
| 4.4g |
解得:x=10.6g y=7.3g
所以盐酸中溶质的质量分数为:
| 7.3g |
| 100g |
(2)氯化钠的质量为13g-10.6g=2.4g
答:混合物中氯化钠的质量为2.4g
(3)由于二氧化碳能够溶于水,所以实验过程会由于二氧化碳溶于水而使反应溶液的质量偏大,从而使二氧化碳的质量偏低,这样会造成结果的偏差.
故答案为:(1)4.4g;7.3%;
(2)2.4g;
(3)二氧化碳部分溶于水.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?吉安模拟)玻璃工艺品如今做的越来越精美,如图是一块雕刻了精美图案的玻璃,小铭对它的制作过程产生了浓厚兴趣,通过查阅资料了解到玻璃雕刻过程中用到的是氢氟酸,发生的反应为4HF+SiO2=SiF4↑+2H2O,则下列说法正确的是( )
(2013?吉安模拟)玻璃工艺品如今做的越来越精美,如图是一块雕刻了精美图案的玻璃,小铭对它的制作过程产生了浓厚兴趣,通过查阅资料了解到玻璃雕刻过程中用到的是氢氟酸,发生的反应为4HF+SiO2=SiF4↑+2H2O,则下列说法正确的是( ) ”表示能反应,“
”表示能反应,“ ”表示不反应,则它们的金属活动性由弱到强的顺序是( )
”表示不反应,则它们的金属活动性由弱到强的顺序是( )


