题目内容
【题目】从事科学实验的重要环节是进行科学实验设计。科学实验的正确步骤应为:①明确实验目的;②收集有关资料;③设计合理方案;④进行科学实验;⑤反思与应用。请你按照上述步骤,完成下列实验设计,根据下图回答问题。
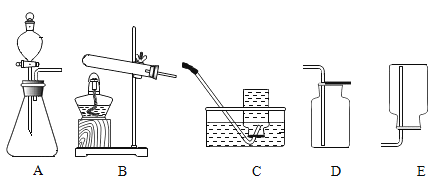
(1)在实验室中用过氧化氢![]() 制取氧气。
制取氧气。
(实验目的)用过氧化氢在实验室里制取氧气。
(收集资料)过氧化氢是一种无色液体,在二氧化锰的催化作用下,迅速分解放出氧气,该反应的文字表达式为_______。
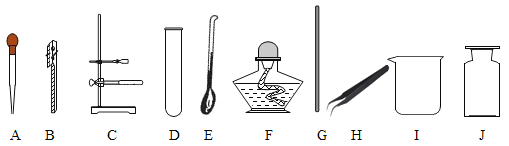
(设计方案)发生装置选用______(填序号,下同),收集装置选用_____,因为______。
(2)在实验室中,可以用加热氯酸钾![]() 和二氧化锰固体混合物制取氧气。
和二氧化锰固体混合物制取氧气。
(实验目的)加热氯酸钾![]() 和二氧化锰固体混合物制取氧气。
和二氧化锰固体混合物制取氧气。
(收集资料)氯酸钾是白色固体,二氧化锰是黑色固体,且二氧化锰在该反应中的作用是_______。
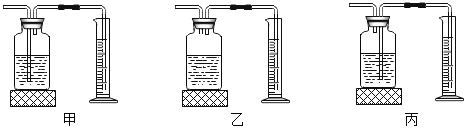
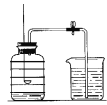
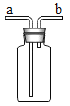
(设计方案)发生装置选用______,若选用D装置收集氧气,你验证集气瓶中是否已收集满氧气的方法是______。若使用下图所示装置收集较纯净的氧气,则应先将装置中装满水,再将气体从____(填“a”或“b”)端通入。
(反思与应用)乙炔又称电石气,是一种无色、无味、密度比空气的略小,不溶于水的气体;实验室用电石(固体)与水反应制取乙炔,你认为制取乙炔应选择的发生装置是_____,收集装置是____。
【答案】![]() A C或D 氧气不易溶于水、密度比空气大 催化剂 B 将带火星的木条靠近集气瓶口,木条复燃,则满 b A C
A C或D 氧气不易溶于水、密度比空气大 催化剂 B 将带火星的木条靠近集气瓶口,木条复燃,则满 b A C
【解析】
(1)收集资料:
过氧化氢在二氧化锰的催化作用下,生成水和氧气,该反应的文字表达式为:![]() 。
。
该反应属于固液混合不需加热型,发生装置选用A,收集装置选用C或D,因为氧气不易溶于水、密度比空气大。
(2)
加热氯酸钾制备氧气实验中,二氧化锰在该反应中的作用是催化剂;
该反应属于固-固混合加热型,发生装置选用B,若选用D装置收集氧气,验证集气瓶中是否已收集满氧气的操作是将带火星的木条靠近集气瓶口,木条复燃,则满;若使用万用瓶收集,排水法收集的氧气较纯净,则应先将装置中装满水,再将气体从b端通入,水从a端排出。
(3)反思与应用:
实验室用电石(固体)与水反应制取乙炔,属于固-液混合不需加热型,制取乙炔应选择的发生装置是A,乙炔密度比空气的略小,不溶于水,应使用排水法收集,收集装置是C。

 名校课堂系列答案
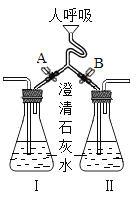
名校课堂系列答案【题目】某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的文字表达式:_____。已知铁丝燃烧生成四氧化三铁。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。

由此可知:蜡烛燃烧产生的火焰是由_____(填“固态”或“气态”)物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
(查阅资料)
物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
石蜡 | 50~70 | 300~550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其_____(填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,_____(填“有”或“没有”)火焰产生。
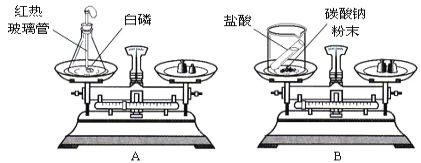
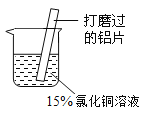
【题目】某小组同学在实验室研究铝与氯化铜溶液的反应,过程如下:
实验操作 | 实验现象 |
| ①铝片表面附着一层红色固体 ②铝片表面意出大量无色气体,放出大量的热 ③袋杯底部出现红色固体和白色沉淀 |
(1)打磨铝片的目的是__________________。
(2)现象①③中的红色固体是同种物质,请写出现象①的化学方程式________________。
(3)经经验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH_______7,证实了甲的猜想。
(4)探究现象③中白色沉淀的化学成分。乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
(查阅资料)CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-,Cu(NH3)2+在空气中易被氧化变为蓝色。
(进行实验)①取烧杯底部的白色沉淀,充分洗涤。洗涤的目的是______________。
②向白色沉淀中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份,进行实验:
操作步骤 | 实验现象 | 实验结论 |
I.用试管取其中一份溶液,滴加适量AgNO3溶液 | 产生白色沉淀 | 该溶液中含有________ |
II.将另一份溶液置于空气中一段时间 | __________________ | 该溶液中含有Cu(NH3)2+ |
(得出结论)通过实验可以确定,该白色沉淀是CuCl。
(反思与评价)Al和CuCl2溶液反应为什么会出现CuCl呢。
I.丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。为了验证猜想,他取Cu与15%的CuCl2溶液混合,结果无白色沉淀产生。他又分析了Al和CuCl2溶液反应的实验现象,再次将打磨过的Al片插入盛有15%的CuCl2溶液的试管,并将试管置于冰水中,发现白色沉淀明显减少。于是他将Cu与15%的CuCl2溶液的实验进行了改进,从而证明了Cu与CuCl2溶液反应能生成CuCl,改进的方法是____________,试写出该反应的化学方程式_______。
II.丁同学认为丙同学的实验还不够严谨,还应考虑____________对Cu与CuCl2溶液反应的影响。