题目内容
【题目】(1)已知:2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则根据质量守恒定律,参加反应的氧气的质量为_____,该物质中一定含有_____元素(填元素符号),各元素的质量比为_____ 。
(2)配平下列化学方程式(化学计量数为1也要填入“_____”上)
① _____Al +_____H2SO4=_____Al2(SO4)3+ _____H2↑
② _____Fe2O3 + _____C![]() _____Fe + _____CO2↑
_____Fe + _____CO2↑
③ _____NH3+_____O2=_____NO + _____+H2O
④ _____C2H4 + _____O2![]() _____H2O + _____CO2
_____H2O + _____CO2
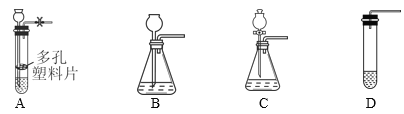
(3)小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置如图:
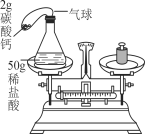
①根据实验目的,小李必须测量的数据是_____
A 锥形瓶质量
B 气球质量
C 反应前整个反应装置(包括里边的物质)质量
D 反应后整个反应装置(包括里边的物质)质量
②将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向_____倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因_____。
③另取一定量的块状大理石与稀盐酸反应,充分反应后得到气体 0.44 g,请计算参与反应的碳酸钙的质量_____。
【答案】4.8g C、H、O 12:3:8 2 3 1 3 2 3 4 3 4 5 4 6 1 3 2 2 CD 右 气球鼓起后有向上的浮力作用 1g
【解析】
(1)已知:2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则根据质量守恒定律,参加反应的氧气的质量=4.4g+2.7g-2.3g=4.8g;二氧化碳中氧元素质量与水中氧元素质量之和为4.4g×![]() =5.6g,大于氧气质量,则该物质中一定含有碳(C)、氢(H)、氧(O)三种元素,二氧化碳中碳元素质量为:4.4g-3.2g=1.2g;水中氢元素质量为:2.7g-2.4g=0.3g,氧元素质量为5.6g-4.8g=0.8g;则碳、氢、氧三种元素质量比1.2g:0.3g:0.8g=12:3:8;
=5.6g,大于氧气质量,则该物质中一定含有碳(C)、氢(H)、氧(O)三种元素,二氧化碳中碳元素质量为:4.4g-3.2g=1.2g;水中氢元素质量为:2.7g-2.4g=0.3g,氧元素质量为5.6g-4.8g=0.8g;则碳、氢、氧三种元素质量比1.2g:0.3g:0.8g=12:3:8;
(2)① 2Al +3H2SO4=1Al2(SO4)3+ 3H2↑
②2Fe2O3 +3C![]() 4Fe +3CO2↑
4Fe +3CO2↑
③ 4NH3+5O2=4NO + 6H2O
④1C2H4 + 3O2![]() 2H2O + 2CO2
2H2O + 2CO2
(3)用盐酸与碳酸钙粉末反应验证质量守恒定律,须测量的数据是:
C 反应前整个反应装置(包括里边的物质)质量
D 反应后整个反应装置(包括里边的物质)质量
故选:CD。
②将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。分析原因:气球鼓起后有向上的浮力作用;
③解:设参与反应的碳酸钙的质量x。

![]() x=1g
x=1g
参加反应碳酸钙的质量为1g。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案