题目内容
【题目】地壳里各种元素的含量(质量分数)如下图所示:
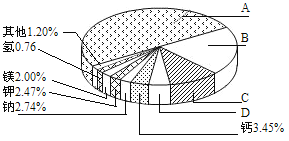
(1)图中表示铝元素的是 ________(填字母);
(2)铁元素的含量排在第4位。铁丝在空气中加热铁丝时只能发生______现象,不能燃烧。铁丝在氧气中能燃烧,在集气瓶中需要预先放入一些水,目的是_________。
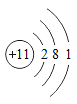
(3)如图是钠原子的结构示意图,在化学变化中钠原子容易___________(填“得到”或“失去”)一个电子。
【答案】C 红热 防止高温融化物溅落炸裂瓶底 失去
【解析】
(1)地壳中含量前四位的元素是:氧、硅、铝、铁,C含量第三是铝元素;
(2)铁丝在空气中加热铁丝时只能发生红热现象,不能燃烧。铁丝在氧气中能燃烧,在集气瓶中需要预先放入一些水,目的是:防止高温融化物溅落炸裂瓶底。
(3)钠原子是第11号元素,原子最外层1个电子,容易失去1个电子形成钠离子。

【题目】请回忆你学习过的“质量守恒定律”的实验探究,并按要求完成实验方案一和实验方案二。(下表中“实验结论”填“=”“>”或“<”)
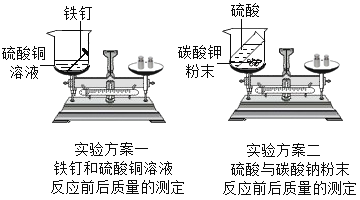
实验方案 | 方案一 | 方案二 |
反应现象 | 铁钉表面覆盖一层红色的物质,溶液由蓝色变成__________色 | 有气泡产生 |
化学方程式 | ________________ | H2SO4+K2CO3= K2SO4+CO2 |
反应前的总质量 | m1 | n1 |
反应后的总质量 | m2 | n2 |
实验结论 | m1_______m2 | n1________n2 |
将两个实验结果进行讨论对比时,有同学有一个方案观察到天平不平衡,是因为________,因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是___________。
【题目】小俊在实验室测定空气中氧气的含量。

(1)小俊利用图A所示装置实验时,取下橡胶塞,点燃红磷迅速伸入集气瓶中并塞紧橡胶塞,打开止水夹前看到的现象是____________,涉及到化学方程式为_____________;
(2)在实验室中小俊发现了如下图B所示的改进装置,并在装置的使用说明上阅读到了白磷和红磷的相关知识:
红磷 | 紫红或略带棕色的固体 | 难溶于水,密度比水大 | 200℃以上着火(约260℃) | 燃烧时产生白烟,烟有毒。化学性质比白磷差,在常温下稳定,难与氧反应。 |
白磷 | 白色或浅黄色半透明性固体。 | 不溶于水,密度比水大 | 在湿空气中约30℃着火,在干燥空气中则稍高。 | 有毒。人的手温就容易使白磷燃烧,所以取用时必须用镊子,存放多在冷水中。 |
①B装置的优点是_____________(只写一点);
②装置中粗铜丝的作用是___________;
③从理论上分析,玻璃管内液面最终将上升至___________处(填1、2、3、4);
④在老师的协助下,小俊用B装置也做了测定了空气中氧气的含量,发现实验测结果液面偏低,其原因可能是__________。