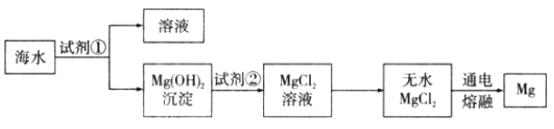
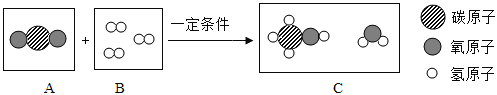
题目内容
【题目】下图A、B、C为三种物质的溶解度曲线,据图回答:
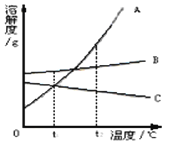
(1) t2℃时, A、B、C三种物质的溶解度由大到小顺序是 _____________
(2) 将t2℃时的等质量三种物质的饱和溶液分别降到0℃时,析出溶质最多的是________。
(3)当 A中含有少量B时为了得到纯净的A,可采用 ________的方法
(4)若将t2℃三种物质的饱和溶液分别降到t1℃时,则三种溶液中溶质的质量分数由大到小的顺序是___________。
【答案】 A>B>C A 降温结晶 B>A>C
【解析】(1)t2℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t2℃时它们的溶解度大小顺序是:A>B>C;(2)温度降低,A的溶解度变化最大且随温度的降低而减小,B的溶解度受温度影响不大略微减小,C的溶解度随温度的升高而增大,故析出晶体最多的是A,无晶体析出的是C;(3)B的溶解度受温度影响不大,A的溶解度受温度影响较大,A中含少量的B时降温A会大量的结晶析出;(4)t2℃时,溶解度A>B>C,所以t2℃时A的饱和溶液溶质质量分数最多其次是B,最小的是C;t1℃时溶解度B>A=C,所以将t2℃时的A、B、C三种物质的饱和溶液降低温度到t1℃,B的溶解度最大,A、C的溶解度相等,但A、B是饱和溶液,C是不饱和溶液,故溶质质量分数最大的是B其次是A最小的是C。

【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如图.下列说法错误的是( )
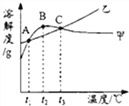
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
A. 乙为NH4Cl
B. t3应介于40℃﹣50℃
C. 55℃时,分别将两饱和溶液蒸发等质量的水,得到固体质量甲>乙
D. 等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等
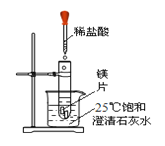
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中然烧的实验(如图1)。
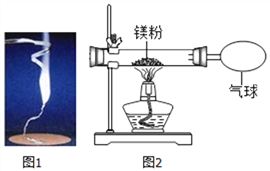
同学们观察到镁条在空气中剧烈燃烧,发出耀眼的白光,因此镁在军事上作_________;
同时同学们还观察到产生的大量白烟弥漫到空气中,最后一些白色固体掉落在仪器A上。
(1)上述仪器A名称是____________。
(2)同学们通过称量发现:在仪器A上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:____________。
(3)小红按下图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁( Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
实验操作 | 实验现象及结论 |
_______________________ | ________________ |
【反思与交流】
①写出镁条燃烧生成氮化镁的化学方程式为____________________;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_________________;
③同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识:___________