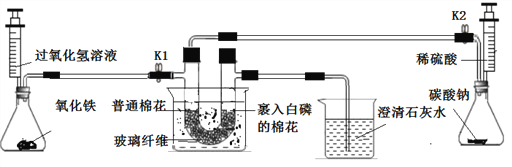
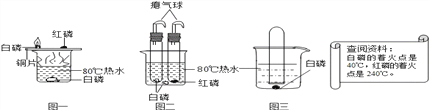
��Ŀ����
����Ŀ��С��������е�ˮ������ˮʱ�����ֺ�����Щ��ɫ�Ĺ��塣Ϊ��̽����ɷ֣�����ȤС��ͬѧ�������Ϻ��֪��Щ��ɫ�Ĺ�����ˮ��������������Ϊˮ�к���Ca(HCO3)2��Mg(HCO3)2�ȿ����������ڼ���ʱ������CaCO3��Mg(OH)2��
��1�����н϶�Ca(HCO3)2��ˮ��_____���Ӳˮ������ˮ����������ʱ������Ӧ�Ļ�ѧ����ʽΪ__________��
��2��С����Ϊ��������˹�ص�ò����ʯ����Ϊ������ˮ���ijɷ�ֻ��CaCO3����С�ײ�ͬ�⣬��ΪҲ����ֻ��Mg(OH)2��������______________��
��3��С��Ϊ��֤���Լ��IJ��룬�������ʵ�鷽����
ʵ����� | �� �� | �� �� |
��ȡ����ˮ�����Թ��У����������_______�� | �۲쵽����_________�� ��Ӧ�Ļ�ѧ����ʽ__________�� | ˮ������CaCO3 |
����ٷ�Ӧ����Թ��еμ�2-3��NaOH��Һ | �۲쵽����__________�� | ˮ����û��Mg(OH)2�� �ҵIJ������ |
��4��С�ײ��Ͽ�С���Ľ��ۣ���Ϊ����ʵ�������ȱ�ݣ�ԭ����_________________________��
���𰸡� Ӳˮ Ca(HCO3)2![]() CaCO3��+H2O+CO2�� CaCO3��Mg(OH)2 ϡ��������ϡHNO3�� �����ܽ⣨��ʧ����������ð�� CaCO3+2HCl==CaCl2+H2O+CO2�� û�г������������Ա仯�� С��ʵ�����������������NaOH̫�٣��������Ƿ���þ��Mg2+��MgCl2��
CaCO3��+H2O+CO2�� CaCO3��Mg(OH)2 ϡ��������ϡHNO3�� �����ܽ⣨��ʧ����������ð�� CaCO3+2HCl==CaCl2+H2O+CO2�� û�г������������Ա仯�� С��ʵ�����������������NaOH̫�٣��������Ƿ���þ��Mg2+��MgCl2��
��������ˮ���ں�ɫ�Ĺ��壬��������Ϊˮ�к���Ca(HCO3)2��Mg(HCO3)2�ȿ����������ڼ���ʱ������CaCO3��Mg(OH)2����1�����н϶�Ca(HCO3)2��ˮ��Ӳˮ��Ӳˮ�Ǻ��н϶�����ӣ�þ���ӵ�ˮ������ʱ������Ӧ�Ļ�ѧ����ʽΪCa(HCO3)2![]() CaCO3��+H2O+CO2����
CaCO3��+H2O+CO2����
��2��С����Ϊ��ˮ���ijɷ�ֻ��CaCO3����С�ײ�ͬ�⣬��ΪҲ����ֻ��Mg(OH)2��������CaCO3��Mg(OH)2���������غ㶨�ɿ�֪������3��С���������ʵ�鷽����
ʵ����� | �� �� | �� �� |
��ȡ����ˮ�����Թ��У����������ϡ��������ϡHNO3���� | �۲쵽�����ǹ����ܽ⣨��ʧ����������ð������Ӧ�Ļ�ѧ����ʽ��CaCO3+2HCl==CaCl2+H2O+CO2���� | ˮ������CaCO3 |
����ٷ�Ӧ����Թ��еμ�2-3��NaOH��Һ | �۲쵽������û�г������������Ա仯���� | ˮ����û��Mg(OH)2���Ȼ�þ���������Ʒ�Ӧ����������þ��ɫ���� �ҵIJ������ |
��4��С�ײ��Ͽ�С���Ľ��ۣ���Ϊ����ʵ�������ȱ�ݣ�ԭ����С��ʵ�����������������NaOH̫�٣��������Ƿ���þ��Mg2+��MgCl2����
�㾦��ˮ����Ҫ�ɷ���CaCO3��Mg(OH)2�����н϶�����ӣ�þ���ӵ�ˮ����ΪӲˮ��̼�����β��ȶ��������ֽ⡣

����Ŀ��Ƥ���ֳ��ɻ����������ζ���أ���������ϲ����ij��ȤС�����г��ϻ������������Ƥ����ԭ�ϡ��õ�ʵ���ҽ���ʵ�顣���ù�����������ձ��У�������������������ˮ������ܽ����ˣ��õ���ɫ����A����ɫ������ҺB��
��������⡿![]() ��ɫ����A��ʲô��
��ɫ����A��ʲô��
(2)��ɫ��ҺB�е���������Щ��
���������ϡ�����Ƥ����ԭ���䷽������NaCl��CaO����![]() �Ĺ������
�������
������������![]() ��ɫ����A��
��ɫ����A��![]() ����д�����ɸó����Ļ�ѧ����ʽ______��
����д�����ɸó����Ļ�ѧ����ʽ______��
![]() ��ҺB�к���
��ҺB�к���![]() ��NaOH��NaCl�������ʡ�
��NaOH��NaCl�������ʡ�
��ʵ����֤��Ϊ֤����ҺB�д��ڵ��������ʣ�ͬѧ�ǽ���������ʵ�顣
���� | ʵ����� | ʵ������ | ʵ����� |
I | ȡ������ҺB���Թ��У���������� | ______ | ��ҺB�к��� |
II | ȡ��������I��������Һ���Թ��У������̪��Һ | ______ | |
III | ��ȡ��������I��������Һ���Թ��У��ȼ���������ϡ���ᣬ�ټ��� ______ ��Һ | ������ɫ���� |
����չ������
![]() ����I������
����I�м������![]() ��Һ��Ŀ����______��
��Һ��Ŀ����______��
![]() С��ͬѧ��Ϊ��������I�е�
С��ͬѧ��Ϊ��������I�е�![]() ��Һ��Ϊ
��Һ��Ϊ![]() ��Һ����������ʵ�飬����Ҳ��֤����ҺB�д��ڵ��������ʡ�����Ϊ�Ƿ����______
��Һ����������ʵ�飬����Ҳ��֤����ҺB�д��ڵ��������ʡ�����Ϊ�Ƿ����______![]() ����������������������
����������������������![]() ��
��
![]() С��ͬѧ��Ϊ����ҺB���ȼ����̪��Һ������������
С��ͬѧ��Ϊ����ҺB���ȼ����̪��Һ������������![]() ��Һ��Ҳ�ܵó���ҺB�������к���
��Һ��Ҳ�ܵó���ҺB�������к���![]() ��NaOH�Ľ��ۣ����Ƿ�ͬ�����Ĺ۵㲢˵������______��
��NaOH�Ľ��ۣ����Ƿ�ͬ�����Ĺ۵㲢˵������______��
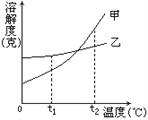
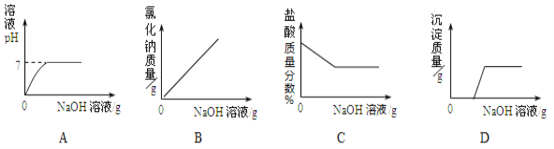
����Ŀ��NH4Cl��Na2SO4���ܽ�ȱ����ܽ��������ͼ������˵���������( )

�¶�/�� | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ��S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
A. ��ΪNH4Cl
B. t3Ӧ����40����50��
C. 55��ʱ���ֱ���������Һ������������ˮ���õ����������ף���
D. �������ļס��ұ�����Һ��t3���µ�t1�������ľ����������