题目内容
28、现有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成.现做如下实验:①取少量粉末,加水溶解得无色溶液;②另取少量粉末,滴加稀盐酸,无明显现象.请回答:
(1)由上述实验可确定原粉末中一定没有
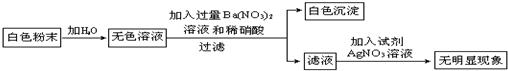
(2)为进一步确定原粉末的组成,另取少量粉末按下图所示进行实验:
请用化学式表示原粉末的成分
(1)由上述实验可确定原粉末中一定没有
CuSO4、Na2CO3
;可能含有的物质是NaCl、Na2SO4
.(2)为进一步确定原粉末的组成,另取少量粉末按下图所示进行实验:
请用化学式表示原粉末的成分
Na2SO4
;写出有关化学方程式Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3
;上述实验中,无色溶液中加入的Ba(NO3)2溶液不能用BaCl2溶液取代,原因是加入氯化钡也就加入了Cl-,影响后面对Cl-的检验
.
分析:(1)利用CuSO4溶于水呈蓝色、Na2CO3与盐酸可产生气体CO2,根据实验①②的实验现象进行判断而得到结论;
(2)要确定原粉末的成份,也就是要检验Cl-和SO42-的存在情况,要注意两种离子的检验顺序,应先用钡离子检验是否有硫酸根离子,若有并将其除去,再用银离子检验Cl-.
(2)要确定原粉末的成份,也就是要检验Cl-和SO42-的存在情况,要注意两种离子的检验顺序,应先用钡离子检验是否有硫酸根离子,若有并将其除去,再用银离子检验Cl-.
解答:解:
(1)根据实验现象加水溶解得无色溶液,可知一定没有硫酸铜,因为硫酸铜溶液为蓝色.加入稀盐酸无明显现象,可知一定没有碳酸钠,因为盐酸与碳酸钠反应会有气泡冒出,故一定没有CuSO4、Na2CO3;而NaCl和Na2SO4可能有也可能没有,不能确定,故可能含有NaCl、Na2SO4;
(3)要知道原粉末的成份,也就是检验Cl-和SO42-是否存在,而检验Cl-需加入Ag+,检验SO42-需加入Ba2+;若先加入Ag+检验Cl-,Cl-遇到Ag+会生成氯化银沉淀,溶液浑浊,Ag+遇到SO42-生成的硫酸银微溶于水,也会造成溶液浑浊,因此必须先加入钡离子检验SO42-,并且要加入过量的Ba2+把SO42-全部除去,否则SO42-会对Cl-的检验造成干扰;不能加入氯化钡,因为加入氯化钡也就加入了Cl-,即使原溶液中没有Cl-现在也加入了Cl-,因此只能使用硝酸钡检验是否含有硫酸钠,再加硝酸银检验是否含有氯化钠;根据题中的现象可知原粉末中只有硫酸钠.
故答案为:
(1)CuSO4、Na2CO3;NaCl、Na2SO4;
(2)Na2SO4;Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3;加入氯化钡也就加入了Cl-,影响后面对Cl-的检验.
(1)根据实验现象加水溶解得无色溶液,可知一定没有硫酸铜,因为硫酸铜溶液为蓝色.加入稀盐酸无明显现象,可知一定没有碳酸钠,因为盐酸与碳酸钠反应会有气泡冒出,故一定没有CuSO4、Na2CO3;而NaCl和Na2SO4可能有也可能没有,不能确定,故可能含有NaCl、Na2SO4;
(3)要知道原粉末的成份,也就是检验Cl-和SO42-是否存在,而检验Cl-需加入Ag+,检验SO42-需加入Ba2+;若先加入Ag+检验Cl-,Cl-遇到Ag+会生成氯化银沉淀,溶液浑浊,Ag+遇到SO42-生成的硫酸银微溶于水,也会造成溶液浑浊,因此必须先加入钡离子检验SO42-,并且要加入过量的Ba2+把SO42-全部除去,否则SO42-会对Cl-的检验造成干扰;不能加入氯化钡,因为加入氯化钡也就加入了Cl-,即使原溶液中没有Cl-现在也加入了Cl-,因此只能使用硝酸钡检验是否含有硫酸钠,再加硝酸银检验是否含有氯化钠;根据题中的现象可知原粉末中只有硫酸钠.
故答案为:
(1)CuSO4、Na2CO3;NaCl、Na2SO4;
(2)Na2SO4;Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3;加入氯化钡也就加入了Cl-,影响后面对Cl-的检验.
点评:解答本题需要注意混合物中Cl-和SO42-的检验顺序:由于Ag+和SO42-能形成微溶于水的硫酸银造成溶液浑浊,干扰了溶液中Cl-的检验,所以一定要先检验SO42-,再检验Cl-.

练习册系列答案
相关题目