题目内容
【题目】自来水厂常用氯气对自来水进行杀菌消毒。
(1)自来水用氯气杀菌消毒的过程中发生____________(填“化学”或“物理”)变化。
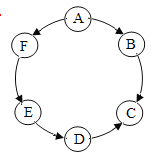
(2)用氯气给自来水消毒时的微观过程如下图所示,下列有关图甲的分析判断正确的是________。
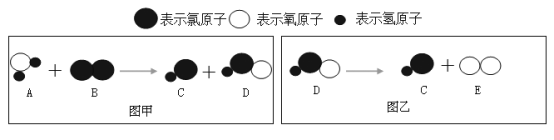
A.A中氢元素与氧元素的质量比为1:8
B.反应前后分子种类改变
C.该反应类型属于置换反应
D.反应前后元素种类不变
【答案】化学 ABD
【解析】
(1)自来水用氯气杀菌消毒是氯气溶于水生成次氯酸,次氯酸杀灭水中的细菌、病毒,发生的是化学变化。
故填:化学。
(2)依照微观示意图可得:A是H2O、B是Cl2、C是HCl、D是HClO、E是O2;图甲发生反应的化学方程式是![]() ;
;
A、A是H2O,水中氢元素与氧元素的质量比为1:8,故选项A正确;
B、化学反应前后分子的种类发生改变,故选项B正确;
C、该反应是一种单质和一种化合物反应生成了两种化合物,不是置换反应,故选项C不正确;
D、根据质量守恒定律,反应前后元素的种类不变,故选项D正确。
故选:ABD。

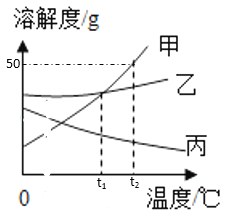
【题目】下列实验设计不能达到目的的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
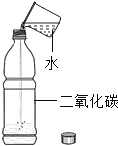
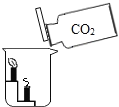
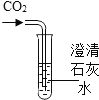
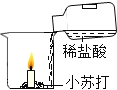
实验 目的 | 证明二氧化碳能溶于水 | 证明二氧化碳密度大于空气 | 证明通入的气体 是二氧化碳 | 证明小苏打能与稀盐酸反应放出 CO2 |
A. AB. BC. CD. D
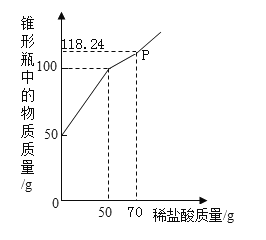
【题目】某实验小组的同学在做酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液中加入一定量的稀硫酸后,发现忘了滴加酸碱指示剂。因此,他们停止滴加稀硫酸,并对烧杯内溶液中的溶质成分进行了探究。
[提出问题]该烧杯内溶液中的溶质是什么?
[猜想假设]猜想一:只有Na2SO4;
猜想二:___________________________。
猜想三:含有Na2SO4和NaOH。
[查阅资料]硫酸钠溶液呈中性。
[进行实验]同学们设计了如下不同的实验方案,证明猜想二是成立的。请你帮他们填写有关实验步骤或实验现象。
方案 | 实验步骤 | 实验现象 |
方案一 | 取少量烧杯中的溶液于试管中,加入紫色石蕊溶液 | ___________________________。 |
方案二 | 取少量__________________于试管中,加入一定量的烧杯中的溶液 | 固体溶解,溶液变为黄色 |
方案三 | 取少量烧杯中的溶液于另- -支试管中,加入氯化钡溶液 | ___________________________。 |
方案四 | ___________________________。 | 产生气泡. |
[反思交流]
(1)上述方案有一个不合理,请指出并说明理由___________________________。
(2)方案二中反应的化学方程式为___________________________。
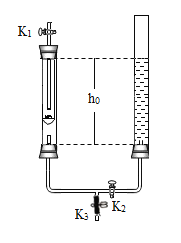
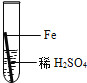
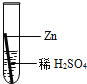
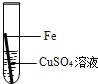
【题目】在实验课中,各小组作了如下实验:
实验编号 | 1 | 2 | 3 | 4 |
实验操作 |
|
|
|
|
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜.经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同.
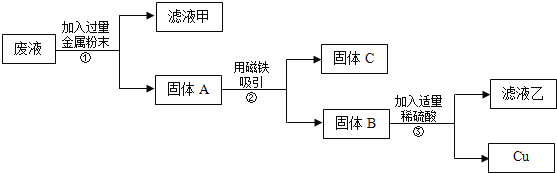
则固体C是 ,操作③的名称是 ,实验中所加的过量金属粉末是 .