题目内容
【题目】现有7.5g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示(石灰石样品中的杂质不发生反应).求:
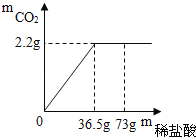
(1)该石灰石样品中碳酸钙的质量分数?
(2)所用的盐酸的溶质的质量分数是多少?
【答案】(1)该石灰石样品中碳酸钙的质量分数为66.7%.(2)所用的盐酸的溶质的质量分数为:![]() ×100%=10%.
×100%=10%.
【解析】
试题分析:石灰石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
根据图中提供的数据可知生成二氧化碳的质量是2.2g,恰好完全反应时消耗稀盐酸的质量是36.5g,根据二氧化碳的质量可以计算碳酸钙的质量和反应的氯化氢的质量,进一步可以计算该石灰石样品中碳酸钙的质量分数和所用的盐酸的溶质的质量分数.
解:(1)设碳酸钙的质量为x,36.5g稀盐酸中氯化氢的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 44
x y 2.2g
![]() =
=![]() =
=![]() ,
,
x=5g,y=3.65g,
该石灰石样品中碳酸钙的质量分数为:![]() ×100%=66.7%,
×100%=66.7%,
答:该石灰石样品中碳酸钙的质量分数为66.7%.
(2)所用的盐酸的溶质的质量分数为:![]() ×100%=10%,
×100%=10%,
答:所用的盐酸的溶质的质量分数为:![]() ×100%=10%.
×100%=10%.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目