题目内容
【题目】某白色固体甲的主要成分为NaCl,可能含有MgCl2、KCl、BaCl2和NaOH中的一种或几种杂质,为检验白色固体甲的成分并除去其中杂质,进行如下实验:
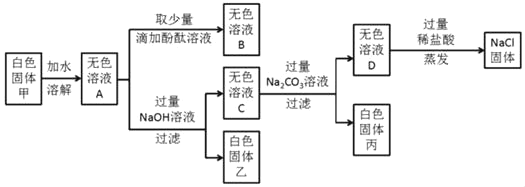
(1)写出生成白色固体丙的化学方程式_____。
(2)向无色溶液D中加入过量稀盐酸的步骤中发生反应的化学方程式为_____;_____。
(3)在蒸发的操作中,当蒸发皿内出现有_____时,应停止加热。
(4)分析上述实验可知,白色固体甲中 一定没有的物质是_____。
(5)若用上述实验中的A、B、C、D四种溶液鉴别稀H2SO4和NaOH溶液,分别取样后,按下图所示操作进行实验,就能达到鉴别目的是实验_____(填实验编号)。
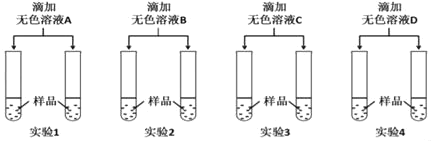
【答案】BaCl2+Na2CO3=BaCO3↓+2NaCl NaOH+HCl=NaCl+H2O Na2CO3+2HCl=2NaCl+H2O+CO2↑ 较多固体 KCl、NaOH 2、3、4
【解析】
(1)白色固体丙是碳酸钡,是因为氯化钡和碳酸钠反应生成白色沉淀碳酸钡和氯化钠,反应的化学方程式:BaCl2+Na2CO3=BaCO3↓+2NaCl。
(2)向无色溶液D中加入过量稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为:NaOH+HCl =NaCl+H2O、Na2CO3+2HCl=2NaCl+H2O+CO2↑。
(3)在蒸发的操作中,当蒸发皿内出现有较多固体时,应停止加热。
(4)分析上述实验可知,白色固体甲中 一定没有的物质是KCl、NaOH。
(5)溶液A中含有的氯化镁能和氢氧化钠反应生成白色沉淀氢氧化镁,氯化钡能和稀硫酸反应生成白色沉淀硫酸钡,因此溶液A不能区分稀硫酸和氢氧化钠溶液;
溶液B中含有酚酞试液,氢氧化钠溶液显碱性,能使酚酞试液变红色,因此溶液B可以区分稀硫酸和氢氧化钠溶液;
溶液C中含有氯化钡,能和稀硫酸反应生成白色沉淀硫酸钡,不含有氯化镁,不能和氢氧化钠反应,因此溶液C可以区分稀硫酸和氢氧化钠溶液;
溶液D中含有碳酸钠,能和稀硫酸反应生成二氧化碳气体,不能和氢氧化钠反应,因此溶液D可以区分稀硫酸和氢氧化钠溶液。
故填:BaCl2+Na2CO3=BaCO3↓+2NaCl;NaOH+HCl =NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑;较多固体;KCl、NaOH;2、3、4。

 考前必练系列答案
考前必练系列答案【题目】某食品外包装标签如图所示。其中含有的能够为人体提供能量的物质是______。资料:苯甲酸钠(C7H5O2Na)是一种食品添加剂,广泛用于食品工业中。请计算:
产品名称:蜜炼柚子罐头 保质期:18个月净含里:500g(瓶) 营养成分表 | ||
项目 | 每(100g) | 营养参考值% |
能量 | 1068KJ | 13% |
蛋白质 | 0(g) | 0 |
脂肪 | 0(g) | 0 |
糖类 | 61.1(g) | 20% |
钠 | 0.23(mg) | 0 |
(1)一个苯甲酸钠中含有______个原子;
(2)C7H5O2Na中碳、氧两种元素的质量比是______;(最简整数比)
(3)若本产品中钠元素全部由苯甲酸钠提供,则一瓶该包装的蜜炼柚子罐头中含有苯甲酸钠的质量为______mg。
【题目】已知氯化钾、硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | 氯化钾 | 27.6 | 34.0 | 40.0 | 45.5 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110.0 | |
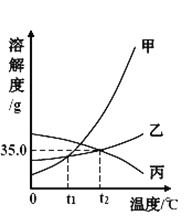
依据上表数据和溶解度曲线判断,下列说法错误的是
A. 能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙
B. t1℃时,氯化钾和硝酸钾的溶解度相等,在 34.0 g 至 35.0 g 之间
C. t2℃时,将接近饱和的丙物质的溶液升高温度,可使其变成饱和溶液
D. 氯化钾中混有少量的硝酸钾,可采用降温结晶的方法提纯