题目内容
【题目】西园中学化学兴趣小组在老师指导下,对碳酸钠、碳酸氢钠的性质作进一步探究。
Ⅰ.探究碳酸钠、碳酸氢钠的热稳定性
【实验过程】
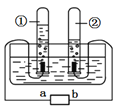
(1)截取一根长短合适的玻璃管,利用酒精喷灯将其加工成长柄双V管。
(2)按下图所示,装好药品和试纸,确保长柄双V管处于水平的平衡状态。
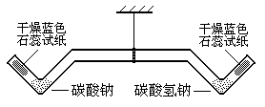
(3)以下操作不考虑空气的干扰。
实验现象 | 实验结论 | |
①用酒精灯加热左端的碳酸钠2 min | 长柄双V管保持水平,干燥的蓝色石蕊试纸不变色 | 碳酸钠受热 |
②再加热右端的碳酸氢钠2min | 长柄双V管右端上升,干燥的蓝色石蕊试纸变成红色 | 碳酸氢钠受热分解成碳酸钠等物质,有关的化学方程式是 |
【拓展延伸】
(4)碳酸钠俗称苏打、 等,常用作洗涤剂。
(5)碳酸氢钠俗称小苏打,常用于 。
Ⅱ.探究碳酸氢钠受热后残留的白色固体成分
【作出猜想】
同学们猜想碳酸氢钠受热后,残留的白色固体成分可能是:
①全部是碳酸氢钠;②全部是碳酸钠;③ 。
老师指出,猜想①无需验证,就知道不合理,因为 。
【查阅资料】
碳酸氢钠溶于水吸收热量,碳酸钠溶于水放出热量。
【设计方案】
同学们设计出下列3个实验方案,其中正确的是 (填序号)。
A.将残留的白色固体溶于水,若有放热现象,则猜想②正确
B.加热一定量残留的白色固体,若质量减轻,则猜想③正确
C.向残留的白色固体中滴加稀盐酸,若有气泡产生,则猜想②正确
【答案】【实验过程】(3)①碳酸钠受热不易分解;②2NaHCO3![]() Na2CO3+ H2O+CO2↑
Na2CO3+ H2O+CO2↑
【拓展延伸】(4)纯碱(5)发酵粉
【作出猜想】③碳酸钠和碳酸氢钠的混合物 原因:碳酸氢钠受热会分解
【设计方案】B
【解析】
试题分析:用酒精灯加热左端的碳酸钠2 min,长柄双V管保持水平,干燥的蓝色石蕊试纸不变色,说明过程中没有产生二氧化碳,因此说明碳酸钠受热不会发生分解;再加热右端的碳酸氢钠2min,长柄双V管右端上升,干燥的蓝色石蕊试纸变成红色,碳酸氢钠受热分解成碳酸钠和二氧化碳等,二氧化碳和水反应产生碳酸,从而使得蓝色的石蕊变为红色,有关的化学方程式是2NaHCO3![]() Na2CO3+ H2O+CO2↑;碳酸钠俗称苏打、纯碱等,常用作洗涤剂。碳酸氢钠俗称小苏打,常用于发酵粉或者治疗胃酸过多等;碳酸氢钠受热后,残留的白色固体成分可能是:①全部是碳酸氢钠;②全部是碳酸钠;③可能是二者的混合物。猜想①无需验证,就知道不合理,因为碳酸氢钠受热会分解;残留的白色固体成分可能是什么,可以通过加热一定量残留的白色固体,若质量减轻,则猜想③正确,因为碳酸氢钠存在就会受热分解,质量就会减少。
Na2CO3+ H2O+CO2↑;碳酸钠俗称苏打、纯碱等,常用作洗涤剂。碳酸氢钠俗称小苏打,常用于发酵粉或者治疗胃酸过多等;碳酸氢钠受热后,残留的白色固体成分可能是:①全部是碳酸氢钠;②全部是碳酸钠;③可能是二者的混合物。猜想①无需验证,就知道不合理,因为碳酸氢钠受热会分解;残留的白色固体成分可能是什么,可以通过加热一定量残留的白色固体,若质量减轻,则猜想③正确,因为碳酸氢钠存在就会受热分解,质量就会减少。