题目内容
(1)下列说法正确的是 .
①饱和溶液一定是浓溶液;
②稀溶液一定是不饱和溶液;
③一定条件下饱和溶液不能再溶解任何物质;
④任何物质的饱和溶液,升高温度后都会变成不饱和溶液;
⑤同温,同溶质,同溶剂的情况下,某物质的饱和溶液中溶质的质量一定比不饱和溶液大.
(2)取相同20℃时,等质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示.图2为a、b、c三种物质的溶解度曲线.回答下列问题:
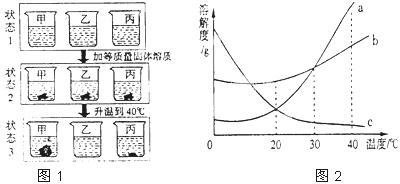
①烧杯乙里是 物质的溶液.
②40℃时,烧杯 里的溶液中溶剂最少.
③各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是 .
A.甲(状态2)>甲(状态1)B.乙(状态3)>丙(状态3)
C.甲(状态1)=乙(状态2)D.乙(状态1)>甲(状态3)
(3)40℃时等质量的a、b、c三种物质的饱和溶液,同时降温到20℃时,三种溶液的溶质质量分数由大到小的顺序为 .
①饱和溶液一定是浓溶液;
②稀溶液一定是不饱和溶液;
③一定条件下饱和溶液不能再溶解任何物质;
④任何物质的饱和溶液,升高温度后都会变成不饱和溶液;
⑤同温,同溶质,同溶剂的情况下,某物质的饱和溶液中溶质的质量一定比不饱和溶液大.
(2)取相同20℃时,等质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示.图2为a、b、c三种物质的溶解度曲线.回答下列问题:

①烧杯乙里是
②40℃时,烧杯
③各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是
A.甲(状态2)>甲(状态1)B.乙(状态3)>丙(状态3)
C.甲(状态1)=乙(状态2)D.乙(状态1)>甲(状态3)
(3)40℃时等质量的a、b、c三种物质的饱和溶液,同时降温到20℃时,三种溶液的溶质质量分数由大到小的顺序为
分析:(1)①根据溶液饱和不饱和与溶液浓稀无关进行解答.
②根据在一定条件下能继续溶解该溶质的溶液称为该溶质的不饱和溶液分析判断;
③根据饱和溶液是指该温度下不能溶解该溶质的溶液分析;
④根据有的固体物质的溶解度随温度的升高而减小进行解答;
⑤根据溶质质量分数的计算公式和饱和溶液、不饱和溶液的基本概念分析.
(2)①根据固体的溶解度曲线可以判断物质的溶解度受温度变化的变化情况分析;
②比较不同物质在同一温度下的溶解度大小,从而确定同温度下的饱和溶液中溶质的质量分数的大小,从而计算出等质量的饱和溶液中溶剂的多少.
③根据物质的溶解度受温度影响的变化,从而可以判断出在升温过程中溶质的质量分数的变化.
(3)根据20℃和40℃时三种物质的溶解度大小、三种物质溶解度随温度的变化情况和饱和溶液溶质质量分数和溶解度的关系分析解答.
②根据在一定条件下能继续溶解该溶质的溶液称为该溶质的不饱和溶液分析判断;
③根据饱和溶液是指该温度下不能溶解该溶质的溶液分析;
④根据有的固体物质的溶解度随温度的升高而减小进行解答;
⑤根据溶质质量分数的计算公式和饱和溶液、不饱和溶液的基本概念分析.
(2)①根据固体的溶解度曲线可以判断物质的溶解度受温度变化的变化情况分析;
②比较不同物质在同一温度下的溶解度大小,从而确定同温度下的饱和溶液中溶质的质量分数的大小,从而计算出等质量的饱和溶液中溶剂的多少.
③根据物质的溶解度受温度影响的变化,从而可以判断出在升温过程中溶质的质量分数的变化.
(3)根据20℃和40℃时三种物质的溶解度大小、三种物质溶解度随温度的变化情况和饱和溶液溶质质量分数和溶解度的关系分析解答.
解答:解:(1)①饱和溶液与浓溶液无关,所以在一定温度下的饱和溶液不一定是浓溶液,该说法不正确;
②不饱和溶液也不一定是稀溶液,故该说法错误;
③饱和溶液是指在一定的温度下在一定的溶剂里不能溶解该溶质的溶液,但还可以溶解气体或其他固体的溶质,故说法错误;
④有的固体物质的溶解度随温度的升高而减小,所以升高温度不一定能使饱和溶液变成不饱和溶液,故错误.
⑤同温,同溶质,同溶剂的情况下,饱和肯定比不饱和时溶解的溶质多,故正确.
(2)①由图可知,状态2变成状态3时,烧杯甲中的溶液中未溶解的溶质增多,说明甲内物质的溶解度随温度的升高而减小,说明烧杯甲内的物质是c;烧杯乙的溶液中的固体全部溶解,而烧杯丙内的溶液中的固体也溶解了一部分,说明烧杯乙内的物质的溶解度在40℃是最大,故烧杯乙内的物质是a,故答案为:a;
②由于三物质的溶液在发生变化的过程中溶剂的质量都没有发生变化,因此比较40℃时溶液中溶剂的质量的多少,只要比较刚开始时溶液中溶剂的质量就行,由于在20℃时三物质的溶解度的大小关系是b>a=c,即在该温度时三物质的饱和溶液中溶质的质量分数大小关系是b>a=c,则等质量的饱和溶液中溶剂的质量大小关系是a=c>b,因此溶剂最少的是丙,故答案为:丙.
③A、由于是在甲的饱和溶液中加入一定量的甲,所以状态1和状态2,甲的溶液中溶质的质量分数相等,故A错误;
B、由于在20℃时,丙中B的溶解度大于乙中A的溶解度,即刚开始时丙中溶液中溶质的质量分数大于乙中溶液中溶质的质量分数,加入等量的溶质升温到40℃时,乙中物质全部溶解,丙中物质部分溶解,因此无法比较所得溶液中溶质的质量分数的大小,故B错误;
C、由于乙的状态2和状态1的溶液中溶质的质量分数是相等的,而甲和乙的状态1的溶液中溶质的质量分数是相等,故C正确;
D、由于在20℃时,A和C的溶解度相等,即它们的饱和溶液中溶质的质量分数相等,而甲中的C的溶解度随温度的升高而减小,升温后溶解度变小,从而使溶液中溶质的质量分数减小,因此乙(状态1)>甲(状态3),故D正确;
故选C、D.
(3)abde 溶解度随温度的降低而减小,40℃时三种物质的溶液,降低温度ab的溶解度都减小,都析出晶体都是饱和溶液,20℃时b的溶解度大于a的溶解度,所以溶质质量分数b的大于a的;降低温度c的溶解度增大,所以c不会析出晶体它的溶质质量分数不变,还等于40℃时它的饱和溶液溶质质量分数;20℃时a的溶解度比40℃时c的溶解度大,所以降温后所得溶液溶质质量分数a的比c的大,故答案:b>a>c.
②不饱和溶液也不一定是稀溶液,故该说法错误;
③饱和溶液是指在一定的温度下在一定的溶剂里不能溶解该溶质的溶液,但还可以溶解气体或其他固体的溶质,故说法错误;
④有的固体物质的溶解度随温度的升高而减小,所以升高温度不一定能使饱和溶液变成不饱和溶液,故错误.
⑤同温,同溶质,同溶剂的情况下,饱和肯定比不饱和时溶解的溶质多,故正确.
(2)①由图可知,状态2变成状态3时,烧杯甲中的溶液中未溶解的溶质增多,说明甲内物质的溶解度随温度的升高而减小,说明烧杯甲内的物质是c;烧杯乙的溶液中的固体全部溶解,而烧杯丙内的溶液中的固体也溶解了一部分,说明烧杯乙内的物质的溶解度在40℃是最大,故烧杯乙内的物质是a,故答案为:a;
②由于三物质的溶液在发生变化的过程中溶剂的质量都没有发生变化,因此比较40℃时溶液中溶剂的质量的多少,只要比较刚开始时溶液中溶剂的质量就行,由于在20℃时三物质的溶解度的大小关系是b>a=c,即在该温度时三物质的饱和溶液中溶质的质量分数大小关系是b>a=c,则等质量的饱和溶液中溶剂的质量大小关系是a=c>b,因此溶剂最少的是丙,故答案为:丙.
③A、由于是在甲的饱和溶液中加入一定量的甲,所以状态1和状态2,甲的溶液中溶质的质量分数相等,故A错误;
B、由于在20℃时,丙中B的溶解度大于乙中A的溶解度,即刚开始时丙中溶液中溶质的质量分数大于乙中溶液中溶质的质量分数,加入等量的溶质升温到40℃时,乙中物质全部溶解,丙中物质部分溶解,因此无法比较所得溶液中溶质的质量分数的大小,故B错误;
C、由于乙的状态2和状态1的溶液中溶质的质量分数是相等的,而甲和乙的状态1的溶液中溶质的质量分数是相等,故C正确;
D、由于在20℃时,A和C的溶解度相等,即它们的饱和溶液中溶质的质量分数相等,而甲中的C的溶解度随温度的升高而减小,升温后溶解度变小,从而使溶液中溶质的质量分数减小,因此乙(状态1)>甲(状态3),故D正确;
故选C、D.
(3)abde 溶解度随温度的降低而减小,40℃时三种物质的溶液,降低温度ab的溶解度都减小,都析出晶体都是饱和溶液,20℃时b的溶解度大于a的溶解度,所以溶质质量分数b的大于a的;降低温度c的溶解度增大,所以c不会析出晶体它的溶质质量分数不变,还等于40℃时它的饱和溶液溶质质量分数;20℃时a的溶解度比40℃时c的溶解度大,所以降温后所得溶液溶质质量分数a的比c的大,故答案:b>a>c.
点评:本题难度较大,主要考查了对固体溶解度的理解和对固体溶解度曲线意义的应用.

练习册系列答案
相关题目