题目内容
(1)下列说法正确的是:
A.点燃氢气和空气的混合气体不一定会发生爆炸
B.点燃氢气前不一定要检验氢气的纯度
C.点燃空气中氢气的体积分数在30%的混合气体会发生爆炸
D.只有绝对纯净的氢气,点燃后才不会发生爆炸
(2)已知:将氢气和氧气的体积按它们生成水时的化学计量数之比进行混合时,爆炸最剧烈.
现若设空气中氧气的体积分数为20%,其余都为氮气,试求:200L空气中混入多少升氢气时爆炸最剧烈?
B、点燃氢气前一定要检验氢气的纯度,否则容易引起爆炸,故B错误;20%
C、点燃空气中氢气的体积分数在30%的混合气体在氢气的爆炸极限10%~70%内,点燃会发生爆炸,故C正确;
D、氢气的爆炸极限为10%~70%,低于10%或高于70%不会发生爆炸,故D错误;
(2)将氢气和氧气的体积按它们生成水时的化学计量数之比进行混合时,爆炸最剧烈,
200L空气中氧气的体积为:200×20%=40L,
由化学方程式2H2+O2═2H2O可知:氢气和氧气的化学计量数之比为2:1,故氢气的体积为40×2=80L.
故答案为
(1)AC;
(2)200L空气中氧气的体积为:200×20%=40L
由化学方程式2H2+O2═2H2O可知:氢气和氧气的化学计量数之比为2:1,故氢气的体积为40×2=80L.

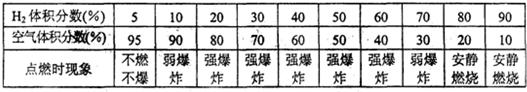
某兴趣小组围绕着“氢气在空气中的爆炸极限”进行探究,记录的现象和数据如下表所示:
| H2体积分数(%) | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 空气体积分数(%) | 95 | 90 | 80 | 70 | 60 | 50 | 40 | 30 | 20 | 10 |
| 点燃时现象 | 不燃不爆 | 弱爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 弱爆炸 | 安静燃烧 | 安静燃烧 |
(1)根据上述实验事实,你可以得出的结论是:
。
(2)教材“单元探究活动”中提到:用排水法收集一小试管氢气,点燃,如果发出“噗”的声音,表明收集的氢气已纯净。根据上述实验事实,分析“氢气已纯净”的真实含义是什么? 。
(3)近年来煤矿瓦斯爆炸事故频发(主要是甲烷气体燃烧爆炸)。你认为采取哪些措施可以预防瓦斯爆炸事故?。(答出两条即可)
。
。
某兴趣小组围绕着“氢气在空气中的爆炸极限”进行探究,记录的现象和数据如下表所示:
| H2体积分数(%) | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 空气体积分数(%) | 95 | 90 | 80 | 70 | 60 | 50 | 40 | 30 | 20 | 10 |
| 点燃时现象 | 不燃不爆 | 弱爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 弱爆炸 | 安静燃烧 | 安静燃烧 |
(1)根据上述实验事实,你可以得出的结论是:
。
(2)教材“单元探究活动”中提到:用排水法收集一小试管氢气,点燃,如果发出“噗”的声音,表明收集的氢气已纯净。根据上述实验事实,分析“氢气已纯净”的真实含义是什么? 。
(3)近年来煤矿瓦斯爆炸事故频发(主要是甲烷气体燃烧爆炸)。你认为采取哪些措施可
以预防瓦斯爆炸事故?
。(答出两条即可)
