题目内容
【题目】实验室用取大理石12.5g,加入盛有100g稀盐酸的烧杯中,两者恰好完全反应(假设其他杂质不与盐酸反应,也不溶解)。烧杯内物质的质量变为108.1g。试计算:
(1)能制取二氧化碳多少g ?
(2)大理石中碳酸钙的质量分数?
【答案】(1)4.4g(2)80%
【解析】
试题分析:(1)根据质量守恒定律可知,反应后质量的减少就为生成的二氧化碳的质量:12.5g+100g-108.1g=4.4g;(2)设大理石中碳酸钙的质量分数为x
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
12.5g×X 4.4g
100:44=(12.5g×X):4.4g
X=80%

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】(10分)铜制器物在潮湿环境中表面会产生绿色的锈迹,俗称铜绿。某化学学习小组对铜绿成分产生了浓厚兴趣。
【提出问题】铜绿中除铜元素外还有其它什么元素?
【查阅资料】①无水硫酸铜遇水变蓝色;
②碳与一般的酸不反应;
③CuO+H2SO4(稀)=CuSO4+H2O。
【实验探究】该小组同学找到了一些铜绿粉末并进行了如下实验:
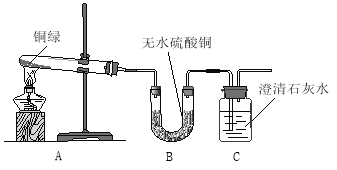
【观察分析】A装置中绿色粉末变为黑色;
B装置中无水硫酸铜变为蓝色;
C装置中澄清石灰水变浑浊,该反应的化学方程式为 。
【实验结论】铜绿中除铜元素外还有 、 和碳等元素。
【交流讨论】根据铜绿的组成,小组同学对A装置中产生的黑色粉末的成分有如下两种不同的猜想:
(1)全部为CuO (2)CuO和C的混合物
【深入探究】
实验步骤 | 实验现象 | 实验结论 |
①取少量黑色粉末于试管中,滴加足量的稀硫酸 | ① | 猜想(1)正确 |
②①取少量黑色粉末于试管中,滴加足量的稀硫酸 | ② | 猜想(2)正确 |
【实验结论】化学学习小组同学通过实验证明猜想(1)正确。
【反思应用】根据铜绿中所含元素,可知铜生锈不仅与空气中的氧气、水有关,还可能与空气中的 等有关;要保护博物馆里的青铜器,减缓生锈,我们可以减少青铜器与 接触。
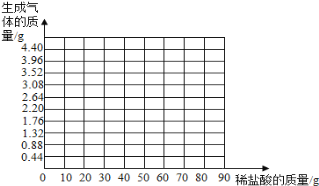
【题目】(10分)小华同学为了测定石灰石样品中碳酸钙的质量分数,取相等质量(14.0g)的五份样品分别和稀盐酸反应,其实验数据记录如下表。(杂质既不溶于水也不跟酸反应;不考虑二氧化碳在水中的溶解)通过对数据的分析和比较,回答下列有关问题:
盐酸的质量(g) | 10 | 20 | 40 | 60 | 80 |
二氧化碳质量(g) | 0.88 | 1.76 | 3.52 | 4.4 | X |
(1)X的数值为 。
(2)7.4g氢氧化钙与 g碳酸钙含的钙元素质量相等?
(3)请在下图中画出在14.0g样品中加稀盐酸的质量与产生气体质量变化的函数关系示意图。
(4)石灰石样品中碳酸钙的质量分数是?(精确到0.1%)