题目内容
【题目】经过学习,你一定掌握了相关气体的制备方法。现有下列实验装置图,回答问题:
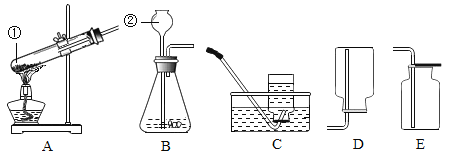
(1)写出标有序号的仪器名称:①_____________②_________
(2)实验室用高锰酸钾制取氧气的化学反应原理是_________ (用化学符号表达式表示)
(3)图中装置A有一处明显错误,请指出_________;改正后,实验室用加热氯化铵和熟石灰两种固体的混合物来制取氨气(化学式NH3),同时生成氯化钙和水。氨气是一种无色、有刺激性气味的、密度比空气小的气体,极易溶于水。则可选择的发生和收集装置为________。
(4)试着写出一种检验B装置气密性的方法_________。
(5)最近媒体报道油炸含有淀粉的食品会产生有毒的丙烯酰胺(化学式为C3H5NO),食用后有害健康。试计算(要求写出计算过程,否则扣分)
①丙烯酰胺的相对分子质量是多少_________?
②丙烯酰胺中氢、氮、氧三种元素的质量比是多少_________?
142g丙烯酰胺中所含碳元素的质量是多少_________?
【答案】试管 长颈漏斗 KMnO4![]() K2MnO4+MnO2+O2↑ 试管口没有略向下倾斜,试管内的导管伸的太长 AD 用弹簧夹夹紧右端的胶皮管,从长颈漏斗注入一定量的水,如果长颈漏斗内能形成一段稳定的水柱,证明装置不漏气 71 5:14:16 72g
K2MnO4+MnO2+O2↑ 试管口没有略向下倾斜,试管内的导管伸的太长 AD 用弹簧夹夹紧右端的胶皮管,从长颈漏斗注入一定量的水,如果长颈漏斗内能形成一段稳定的水柱,证明装置不漏气 71 5:14:16 72g
【解析】
(1)①的仪器名称是试管,②的仪器名称是长颈漏斗。故答案为:试管;长颈漏斗;
(2)高锰酸钾在加热条件下分解为锰酸钾、二氧化锰和氧气,符号表达式是:KMnO4![]() K2MnO4+MnO2+O2↑;故答案为:KMnO4
K2MnO4+MnO2+O2↑;故答案为:KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)加热固体时试管口要略向下倾斜,防止冷凝水倒流引起试管炸裂,制取气体时试管内的导管不能伸的太长,不利于气体的导出;实验室用加热氯化铵(NH4Cl)和熟石灰两种固体的混合物制取氨气,属于“固体加热型”,故选发生装置A,氨气的密度比空气小,所以可用向下排空气法收集;
故答案为:试管口没有略向下倾斜,试管内的导管伸的太长;AD;
(4)检验B装置气密性的方法是:用弹簧夹夹紧右端的胶皮管,从长颈漏斗注入一定量的水,如果长颈漏斗内能形成一段稳定的水柱,证明装置不漏气。故答案为:用弹簧夹夹紧右端的胶皮管,从长颈漏斗注入一定量的水,如果长颈漏斗内能形成一段稳定的水柱,证明装置不漏气;
(5)①丙烯酰胺的相对分子质量是12×3+1×5+16+14=71.
②丙烯酰胺中氢、氮、氧三种元素的质量比是(1×5):(14×1):(16×1)=5:14:16.
③142g丙烯酰胺中所含碳元素的质量是:142g×![]() =72g。
=72g。
故填:71;5:14:16;72g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】请根据下列实验图回答问题
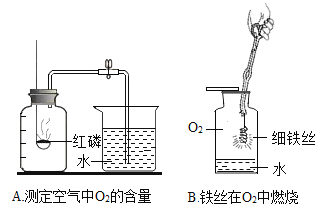
(1)上述两个实验中,水主要对实验仪器起到安全保护作用的是_______(填序号)。
(2)①请写出A实验中发生反应的化学方程式______________________________;
②请写出B实验中的实验现象______________________________;
(3)A实验中,若进入集气瓶中的水小于其体积的五分之一,原因____________________
(4)学校某学习小组的同学对影响过氧化氢分解快慢的因素进行探究。
分别取5 mL H2O2溶液进行实验,测定产生4 mL O2所需时间,实验结果记录如下:
实验 序号 | H2O2溶液的浓度 | 温度 /℃ | MnO2粉 末用量/g | 反应 时间 |
① | 30% | 35 | 0 | t1 |
② | 30% | 55 | 0 | t2 |
③ | 5% | 20 | m | 3 s |
④ | 15% | 20 | 0.1 | 1 s |
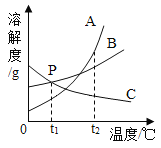
I.对比①②可知:其它条件相同时,温度越高,过氧化氢分解越快,则t1________t2(填“>”、“=”或“<”)。
II.若要探究过氧化氢分解快慢与过氧化氢溶液浓度有关,则m的值为______,选择的实验序号为__________,合理的结论是________________________________。