题目内容
27、归纳与演绎是重要的科学方法,也是常用的化学学习方法.
(1)我们已经学过实验室制取O2、H2、CO2三种气体的反应原理,制取与收集方法,请你归纳出实验室制取气体反应的共同点
A.需要加热 B.使用催化剂 C.没有气体参加反应
D.原料为纯净物 E.只生成一种气体
(2)化学上可以通过多种反应得到SO2(易溶于水,密度比空气大),例如:
①Na2SO3(固)+H2SO4═Na2SO4+SO2↑+H2O
 ②S+O2点燃SO2③CaSO3(固)高温CaO+SO2↑
②S+O2点燃SO2③CaSO3(固)高温CaO+SO2↑
我将选择反应
(1)我们已经学过实验室制取O2、H2、CO2三种气体的反应原理,制取与收集方法,请你归纳出实验室制取气体反应的共同点
C和E
(填序号).A.需要加热 B.使用催化剂 C.没有气体参加反应
D.原料为纯净物 E.只生成一种气体
(2)化学上可以通过多种反应得到SO2(易溶于水,密度比空气大),例如:
①Na2SO3(固)+H2SO4═Na2SO4+SO2↑+H2O
 ②S+O2点燃SO2③CaSO3(固)高温CaO+SO2↑
②S+O2点燃SO2③CaSO3(固)高温CaO+SO2↑我将选择反应
①
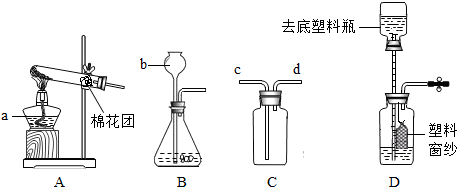
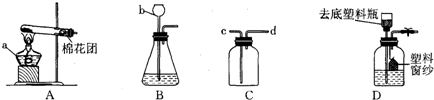
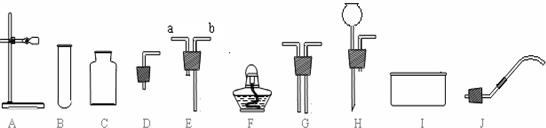
(只写一个,填序号)作为实验室制取SO2的反应原理,我需要用下列仪器中的ABD或ABH
(填序号)来装配SO2发生装置,理由是固体与液体加热且无需加热
.我采用的收集方法是向上排空气法
.选择以上仪器中的C和E
(填序号)来装配收集装置,气流方向是从b
到a
,最后用氢氧化钠溶液
(填试剂名称)来吸收尾气,以免污染环境.分析:O2、H2、CO2三种气体的实验室制取原理分别为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,Zn+H2SO4═ZnSO4+H2↑,CaCO3+2HCl═CaCl2+H2O+CO2↑ 因此在A.需要加热B.使用催化剂 C.没有气体参加反应D.原料为纯净物 E.只生成一种气体这五项中C、E两项相同;实验室制取气体的发生装置选择的依据为反应物的状态和反应的条件,收集装置的选择依据气体本身的密度、溶解性等物理性质;气体中除杂质时,所用试剂能与杂质反应且不与成分气体反应.
解答:解:(1)氢气的制取不需加热、不需要催化剂、原料中稀硫酸为溶液属于混合物,因此A、B、D三项不合理;答案为C、E;
(2)反应的化学方程式为①Na2SO3(固)+H2SO4═Na2SO4+SO2↑+H2O,Na2SO3为固体、H2SO4为液体,应采用“固液混合不加热”的气体发生装置;制取的二氧化硫气体易溶于水,不能用排水法收集,密度比空气大,只能用向上排空气法收集;二氧化硫气体是大气污染物,因此需要尾气处理装置,二氧化硫能与氢氧化钠溶液反应,所以应用氢氧化钠溶液来除去二氧化硫气体.
故答案为(1)C和E;
(2)①;ABD或ABH;固体与液体加热且无需加热;向上排空气法;C和E;b;a;氢氧化钠溶液.
(2)反应的化学方程式为①Na2SO3(固)+H2SO4═Na2SO4+SO2↑+H2O,Na2SO3为固体、H2SO4为液体,应采用“固液混合不加热”的气体发生装置;制取的二氧化硫气体易溶于水,不能用排水法收集,密度比空气大,只能用向上排空气法收集;二氧化硫气体是大气污染物,因此需要尾气处理装置,二氧化硫能与氢氧化钠溶液反应,所以应用氢氧化钠溶液来除去二氧化硫气体.
故答案为(1)C和E;
(2)①;ABD或ABH;固体与液体加热且无需加热;向上排空气法;C和E;b;a;氢氧化钠溶液.
点评:(1)此题重在考查同学们对常用化学仪器的了解和识记情况及连接装置.
(2)属于扩展性问题,气体的实验室制法主要从药品、反应原理、发生装置、收集装置、检验、验满及实验操作注意事项等方面进行比较、归纳,总结实验室制取气体的一般思路和方法.
(2)属于扩展性问题,气体的实验室制法主要从药品、反应原理、发生装置、收集装置、检验、验满及实验操作注意事项等方面进行比较、归纳,总结实验室制取气体的一般思路和方法.

练习册系列答案
相关题目