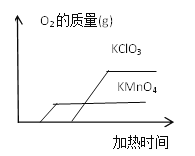
题目内容
【题目】定量研究对于化学科学发展有重大作用,因此我们应该掌握好有关质量守恒定律的相关知识。
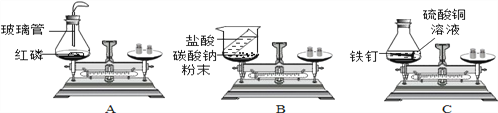
(1)在验证质量守恒定律时,下列A、B、C三个实验设计中,不能达到实验目的的是______(选填序号),理由是_______________。
(2)从微观角度分析,解释反应中,质量守恒定律成立的原因是:_____。
(3)在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | A | B | C | D |
反应前质量/g | 2 | 24.5 | 4 | 8 |
反应后质量/g | 16.9 | 0 | 13.6 | X |
表中X=______,该反应中D物质可能起了_________作用。容器内发生的反应的基本类型是_________。
【答案】 B 盐酸与碳酸钠反应会生成二氧化碳,装置没有密封(或:有二氧化碳逸出) 化学反应前后原子的种类、数目和质量都不变 8 催化(剂) 分解反应
【解析】(1)分析三个实验可以知道,反应A、C中是在密闭的容器中反应,B是在敞口的容器中反应且生成了气体,可以判断B实验前后天平不能保持平衡,不能达到实验目的;(2)根据化学反应的实质可以知道,在反应的过程中是分子破裂成原子,原子进行了重新组合而得到新的分子,所以该过程中原子的种类、原子的数目和原子的质量都没有发生改变,所以化学反应前后质量守恒;(3)根据表格中的信息可以知道,反应前后A、C的质量增加了,所以A、C为生成物,而反应前后B物质的质量减少了,所以B为反应物,结合质量守恒定律可知,A、C增加的质量总和刚好等于B物质减少的质量,所以反应物为B,而生成物为A和C,D的质量不变,所以X=8,D可能是催化剂,器催化作用;化学反应为:B![]()
![]() ,反应的基本类型为分解反应。
,反应的基本类型为分解反应。

【题目】某小组对H2O2溶液制取氧气进行了如下探究:
【探究一】:探究不同催化剂对H2O2分解快慢的影响
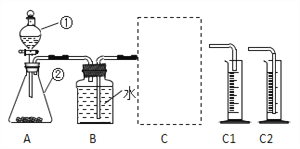
该小组采用了如下图所示装置进行实验,实验中催化剂均为0.4g,H2O2溶液浓度均为10%20mL,在C框中连接导管和量筒,并测量收集到50mL水时的某项数据,经计算后的数据如下表:
催化剂种类 | 气体产生速率(mL/s) |
二氧化锰 | 3.5 |
氧化铜 | 4.5 |
活性炭 | 5.8 |
(1)检查A装置气密性的方法是:用弹簧夹夹住A装置右侧导气管,打开①的两个活塞,向其中加水,若___________,则气密性良好。
(2)C框内选用C1或C2装置,对该探究实验结论有无影响______。
(3)从实验数据可知:相同条件下表中催化剂的催化效果由强到弱依次为________。
(4)该探究实验中,需要测定的数据是____________。
(5)当量筒中收集到50mL水时,双氧水分解出的氧气体积______50mL(填“大于”、“等于”、“小于”)。
【探究二】:探究H2O2溶液浓度对分解速率的影响
如图:在250mL三颈瓶中,加入MnO2均为0.5g,在恒压漏斗中加入不同浓度的H2O2溶液各20mL分别进行实验。并用温度传感器测量并绘制出瓶内温度与时间关系图。如下图所示。
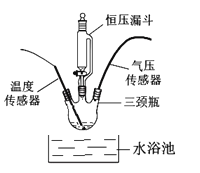
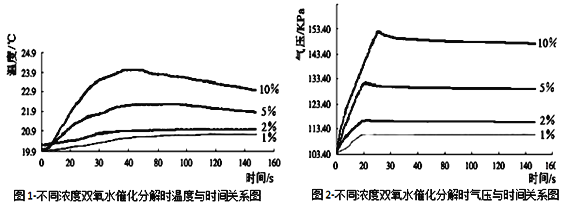
再将该装置的三颈瓶浸入水浴池中(该池可使瓶内的溶液温度恒定在20℃),用上述实验中相同量的各物质重复上述实
验,用气压传感器测量并绘制出瓶内气压与时间关系图。如下图所示。
(6)实验中,恒压漏斗的作用是__________。
(7)由图1知道:H2O2溶液分解时会_________热量(填“放出”或“吸收”)。
(8)由图2知道: H2O2溶液浓度越高,其分解反应速率越______(填“快”或“慢”),以10%H2O2溶液为例,20S后三颈瓶内气压约由高缓慢降低的原因是_________。
(9)影响H2O2溶液分解速率的因素,除了催化剂的种类、H2O2溶液浓度外,还可能有的因素如:__________(请写出一种)。