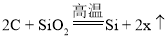题目内容
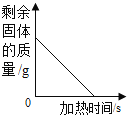
【题目】D 为黑色固体, E 为红色固体,其中 B、E、G 属于单质,下图是它们之间的相互转化关系.请回答:

(1) 固体 D 是_____(写化学式,下同),X 溶液中的溶质是_____。
(2) 写出反应④的化学方程式_____。
(3) 指出反应③的基本反应类型_____。
【答案】Fe3O4 H2SO4、CuSO4 2Cu+O2![]() 2CuO 置换反应
2CuO 置换反应
【解析】
由B、E、G属于单质,E为红色固体,可判断E为铜;铜加热生成氧化铜,A是氧化铜;氧化铜和过量的稀硫酸反应生成硫酸铜和水,X 溶液中的溶质硫酸和硫酸铜;B单质能与硫酸铜和过量稀硫酸反应生成浅绿色溶液、红色固体和无色气体,所以B是铁,F是硫酸亚铁,G是氢气;D为黑色固体,D和Y一氧化碳在高温条件下反应生成铁和C,所以D是四氧化三铁,C是二氧化碳,经验证,推到正确。
(1)由分析可知,固体D 是四氧化三铁,X溶液中的溶质是硫酸和硫酸铜。故填:Fe3O4;H2SO4、CuSO4;
(2)反应④是铜和氧气在加热条件下反应生成氧化铜,反应的化学方程式为:2Cu+O2![]() 2CuO;故填:2Cu+O2
2CuO;故填:2Cu+O2![]() 2CuO;
2CuO;
(3)反应③是铁和稀硫酸反应生成氢气和硫酸亚铁,铁和硫酸铜反应生成铜和硫酸亚铁,这两个反应都是单质与化合物反应生成单质和化合物,属于置换反应。故填:置换反应。

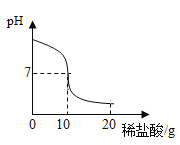
【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)