题目内容
【题目】A~G为初中化学常见物质,相互关系如图所示,“→”表示转化关系,“—”表示相互之间能发生化学反应(部分反应物、生成物及反应条件省略)。A、D是组成元素相同的两种无色液体,乙是空气中的主要成分之一,E是红棕色固体,N是有刺激性气味的气体;H可用于改良酸性土壤;M由两种元素组成,且两种元素的质量比为18︰7。请回答: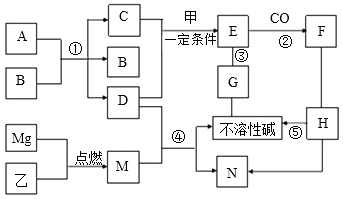
(1)A的化学式 , H的化学式。
(2)B在反应①中的作用是;反应③的现象是;反应⑤的基本类型属于反应。
(3)写出反应②的化学方程式;写出反应④的化学方程式。
【答案】
(1)H2O2,a(OH) 2
(2)催化剂或催化作用,棕色固体逐渐减少,溶液变黄,复分解反应
(3)Fe2O3+3CO ![]() 2Fe+3CO2,Mg3N2+6H3O=3Mg(OH) 2↓+2NH3↑
2Fe+3CO2,Mg3N2+6H3O=3Mg(OH) 2↓+2NH3↑
【解析】A、D是组成元素相同的两种无色液体,说明A和D是H2O和H2O2,A在催化剂MnO2的作用下分解生成D和氧气,则A是H2O2、B是MnO2、C是O2、D是H2O,乙是空气中的主要成分之一,应为N2;E是红棕色固体,则甲为Fe,在潮湿的空气中生锈生成的E为氧化铁;氮化镁溶于水生成的N是有刺激性气味的气体,N应为NH3;H可用于改良酸性土壤,应为氢氧化钙;镁带在氮气中燃烧生成的M,M由两种元素组成,可设为MgxNy,且两种元素的质量比为18︰7,即24x:14y=18︰7,解得:x:y=3:2,则M为Mg3N2;(1)有分析可知A为过氧化氢,其化学式为H2O2,H为氢氧化钙,可用于改良酸性土壤,其化学式为Ca(OH) 2;(2)MnO2在过氧化氢的分解反应中起催化作用;不溶性碱氢氧化镁和氧化铁均能与G反应,结合碱和金属氧化物的性质,可知G为酸,通常为稀盐酸或稀硫酸,则反应③为氧化铁溶于稀盐酸,现象是红棕色固体逐渐减少,溶液变黄;由氢氧化钙制得氢氧化镁,应为碱和盐之间的反应,则反应⑤的基本类型属于复分解反应;(3)CO在加热条件下还原氧化铁生成铁和二氧化碳,反应化学方程式为Fe2O3+3CO ![]() 2Fe+3CO2;氮化镁溶于水生成氢氧化镁和氨气,根据原子守恒得此反应的化学方程式为Mg3N2+6H3O=3Mg(OH) 2↓+2NH3↑。
2Fe+3CO2;氮化镁溶于水生成氢氧化镁和氨气,根据原子守恒得此反应的化学方程式为Mg3N2+6H3O=3Mg(OH) 2↓+2NH3↑。
物质的推断主要是根据已知的实验步骤和实验现象,找出突破口,然后运用物质的特性进行分析推理,判断未知物质或被检验的样品中所的物质。掌握常见物质的性质及物质间相互转化是解题关键。本题的突破口为A、D是组成元素相同的两种无色液体和H可用于改良酸性土壤。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案