题目内容
【题目】根据所示的实验和提供的数据、图像,回答下列问题:

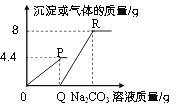
求:(1)a的质量_______g。
(2)b点溶液质量______。(写出计算过程)
(3)恰好完全反应后所得溶液中溶质质量分数______。(写出计算过程)
【答案】4.4g 188.4g 10%
【解析】
解:(1)根据质量守恒定律,生成CO2气体的质量为:18.6g+119.8g+100g-234g=4.4g
(2)设与Na2CO3反应的稀盐酸中的溶质质量为x,
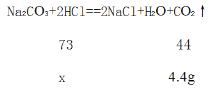
![]() =
=![]() ,解得x=7.3g,则与Na2CO3反应的稀盐酸的质量为:7.3g÷14.6%=50g
,解得x=7.3g,则与Na2CO3反应的稀盐酸的质量为:7.3g÷14.6%=50g
则b点稀盐酸质量为100g-50g=50g
b点溶液质量为:18.6g+119.8g+50g=188.4g
(3)设恰好完全反应后所得溶液中氯化钠的质量为y。
NaOH+HCl==NaCl+H2O,Na2CO3+2HCl==2NaCl+H2O+CO2↑,
根据氯元素质量守恒,可得:
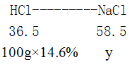
![]() =
=![]() ,解得y=23.4g
,解得y=23.4g
恰好完全反应后所得溶液的质量为:18.6g+119.8g+100g-4.4g=234g
恰好完全反应后所得溶液中溶质质量分数为:![]() ×100%=10%
×100%=10%
答:(1)a的质量 4.4g。
(2)b点溶液质量188.4g。
(3)恰好完全反应后所得溶液中溶质质量分数为10%。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】用化学用语填空:
(1)氦气________; (2)两个氮分子_________;
(3)生活中常用于治疗胃酸过多的盐___________;(4)标出氧化镁中镁元素的化合价_________。
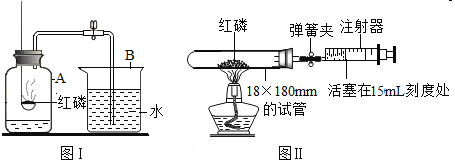
【题目】木炭作为还原剂用于金属冶炼已有几千年历史。教材用如图Ⅰ实验介绍这一知识。
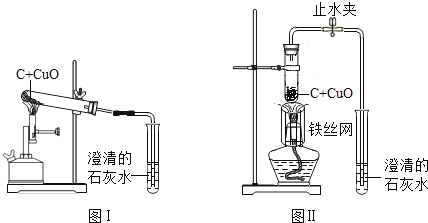
(1).木炭与氧化铜反应的化学方程式是______。
(2).酒精灯火焰处加有铁丝网罩,其作用是______。
(3).固定试管时,试管口要略向下倾斜,其目的是______。
(4).图Ⅰ与教材中的装置还是略作了改进,实验结束时,可先用弹簧夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止______。
(5).为了提高成功率,某研究小组设计如图Ⅱ方案进行实验。
(实验研究)
分别称取2g木炭与![]() 混合物,按每种比例重复实验3次。实验记录如下表:
混合物,按每种比例重复实验3次。实验记录如下表:
总质量相同(2g)但木炭与![]() 比例不同的实验对比表
比例不同的实验对比表
比例 | 1:6 | 1:7 | 1:8 | 1:9 | 1:10~1:11 | 1:12 | 1:13 |
加热时间 |
|
|
|
|
|
|
|
实验现象 | 红热,产生大量气泡,石灰水变浑浊 | 偶尔红热,气泡较少 | |||||
实验结果 | 表层铜球较大,出现未完全反应的黑色木炭粉末,且木炭含量越高黑色粉末越多 | 反应较完全,生成亮红色网状铜块 | 部分生成 | 主要产物是 | |||
由实验数据分析,除温度外,影响实验的因素是______;
从产物分析,该反应混合物的最佳比例范围是______。
(装置改进)
稳定的高温是本实验成功的关键因素之一,实验装置也会影响加热的效率。图Ⅱ装置将卧式装置改为直立式装置。实验时,将反应混合物夯实于试管底部,调节酒精灯使外焰完全包围试管的下部。你认为该设计是否更好?______(填“是”或“否”);理由是______。
(交流讨论)
由于试管中有空气,实验时应注意:
①混合物需进行预热,除了使试管受热均匀外,另外的目的是______。
②从理论上讲,并不能把石灰水变浑浊作为木炭跟![]() 开始反应的充分证据。其理由是______。
开始反应的充分证据。其理由是______。