题目内容
(2006?玄武区二模)(1)将一小块金属钠投入盛有适量水的烧杯中,剧烈反应,生成氢气;(2)向(1)反应后的溶液中滴加硫酸铜溶液,有蓝色沉淀生成.
(3)过滤,将蓝色沉淀加热,得到黑色粉未.
写出实验(1)、(2)、(3)中有关的化学方程式并指出反应的类型(化合、分解、置换、复分解反应):
(1);反应
(2);反应
(3).
【答案】分析:(1)根据活泼金属会与水反应生成碱和氢气进行分析;
(2)根据铜离子和氢氧根离子会生成氢氧化铜沉淀进行分析;
(3)根据不溶性的碱加热会发生分解进行分析;
根据反应物、生成物的类别判断反应的基本类型.
解答:解:(1)钠和水反应生成氢氧化钠和氢气,故答案为:2Na+2H2O=2NaOH+H2↑;
该反应由一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应,故答案为:置换反应;
(2)氢氧化钠和硫酸铜反应生成硫酸钠和氢氧化铜沉淀,故答案为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;
该反应由两种化合物相互交换成分形成两种新的化合物,符合复分解反应的概念,属于复分解反应,故答案为:复分解反应;
(3)氢氧化铜沉淀在加热的条件下生成氧化铜和水,故答案为:Cu(OH)2 CuO+H2O;
CuO+H2O;
该反应由一种物质反应生成两种物质,符合分解反应的概念,属于分解反应,故答案为:分解反应.
点评:在解此类题时,首先分析反应应用的原理,然后找出对应的反应物、生成物以及反应条件,最后按要求书写方程式.
(2)根据铜离子和氢氧根离子会生成氢氧化铜沉淀进行分析;
(3)根据不溶性的碱加热会发生分解进行分析;
根据反应物、生成物的类别判断反应的基本类型.
解答:解:(1)钠和水反应生成氢氧化钠和氢气,故答案为:2Na+2H2O=2NaOH+H2↑;
该反应由一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应,故答案为:置换反应;
(2)氢氧化钠和硫酸铜反应生成硫酸钠和氢氧化铜沉淀,故答案为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;
该反应由两种化合物相互交换成分形成两种新的化合物,符合复分解反应的概念,属于复分解反应,故答案为:复分解反应;
(3)氢氧化铜沉淀在加热的条件下生成氧化铜和水,故答案为:Cu(OH)2
 CuO+H2O;
CuO+H2O;该反应由一种物质反应生成两种物质,符合分解反应的概念,属于分解反应,故答案为:分解反应.
点评:在解此类题时,首先分析反应应用的原理,然后找出对应的反应物、生成物以及反应条件,最后按要求书写方程式.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
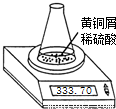 (2006?玄武区二模)测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
(2006?玄武区二模)测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):| 反应时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 锥形瓶及所盛物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.若该数据用a表示,求黄铜屑中锌的质量分数(写出计算过程).
(3)请你再设计一个测定黄铜屑中锌的质量分数的方案.
(2006?玄武区二模)在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
(1)查得室温下10%氢氧化钠溶液的密度为1.02g/cm3,配制100mL这种氢氧化钠溶液,需氢氧化钠______g,其配制过程是______.
如用______mL(填“10mL”、“50mL”或“100mL”)量筒量取水时,面对刻度线,仰视读数,则所配制的溶液______10%(填“=”、“>”或“<”)
(2)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线.
(3)根据曲线讨论溶液温度变化的原因.
①加入盐酸的量在2mL~10mL之间时:______.
②加入盐酸的量在10mL~20mL之间时:______.
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:______.
(5)在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
①你认为此结论是否正确?______,理由是______;
②写出该中和反应的化学方程式______;
③请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(t)/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
如用______mL(填“10mL”、“50mL”或“100mL”)量筒量取水时,面对刻度线,仰视读数,则所配制的溶液______10%(填“=”、“>”或“<”)
(2)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线.

(3)根据曲线讨论溶液温度变化的原因.
①加入盐酸的量在2mL~10mL之间时:______.
②加入盐酸的量在10mL~20mL之间时:______.
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:______.
(5)在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
①你认为此结论是否正确?______,理由是______;
②写出该中和反应的化学方程式______;
③请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 实验方法 | 可能观察到的现象 | 结论 |
(2006?玄武区二模)蜡烛(主要成分:石蜡)是我们生活中的常用品.让我们通过实验共同来探究它的组成及有关性质.
(1)用小刀轻轻切下一小块蜡烛,把它放入水中,发现蜡烛浮在水面上.由此你能得到的结论有①______,②______.
(2)查阅资料后得知石蜡中含有碳等元素.为了验证石蜡中含有碳元素,你将进行怎样的实验操作?试完成实验报告.
(3)我还能提出一个与蜡烛有关,需要再探究的新问题:______.
(1)用小刀轻轻切下一小块蜡烛,把它放入水中,发现蜡烛浮在水面上.由此你能得到的结论有①______,②______.
(2)查阅资料后得知石蜡中含有碳等元素.为了验证石蜡中含有碳元素,你将进行怎样的实验操作?试完成实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
石蜡中有碳元素 |
(2006?玄武区二模)合作探究:某兴趣小组将大小相同的若干块棉布在五分不同体积分数的酒精溶液中浸透后取出点火,做“烧不坏的手帕”实验.其实验结果记录如下:
推测⑤的结果.分析实验②③中“酒精烧完棉布无损”的原因,实验室里常出现酒精灯内有酒精却点不着的现象.你认为可能的原因.
| 实验序号 | ① | ② | ③ | ④ | ⑤ |
| 所用酒精的 体积分数 | 95% | 65% | 55% | 15% | 5% |
| 实验 现象 | 酒精烧完 棉布烧坏 | 酒精烧完 棉布无损 | 酒精烧完 棉布无损 | 不燃烧 |
