题目内容
某研究性学习小组在学习金属铁的知识后,为了解铜及其常见化合物的性质,运用类比的思想提出了如下问题,并进行探究。请帮助完成下列有关研究并填写有关空白。
(1)【提出问题】
①铁能与稀硫酸反应产生氢气,铜能吗?铜与浓硫酸会发生反应吗?
②铁在潮湿的空气中易生锈,铜“生锈”需要什么条件?
③氧化铁能够被一氧化碳还原,氧化铜可以吗?氧化铜能直接转化为氢氧化铜吗?氧化铜还有哪些性质?
④有哪些途径可以由铜逐步转变为氢氧化铜?
(2)【查阅资料与问题解决】
①铜不能与稀硫酸发生置换反应,是因为在金属活动性顺序表中,铜排在 之后。 铜能与浓硫酸发生反应,其反应方程式为: Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑此反应中化合价升高的元素是 。
CuSO4+2H2O+SO2↑此反应中化合价升高的元素是 。
②铜在潮湿的空气中也能“生锈”形成铜绿,铜绿的主要成分为Cu2 (OH)2 CO3。由此可以推测:铜“生锈”过程中,参与反应的物质有铜、氧气、水和 。
③氧化铜可以在加热的条件下被一氧化碳等还原成铜,其与一氧化碳反应的化学方程式为;氧化铜不能与水反应生成氢氧化铜,但能与硫酸、盐酸等发生复分解反应形成相应的铜盐;在高温下,氧化铜能分解成砖红色的氧化亚铜(Cu2O)和氧气,反应的化学方程式为 。
④由铜转化为氢氧化铜,从化学反应的原理看,可以是流程I:
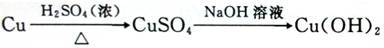
也可以是流程II:
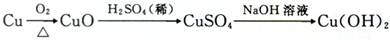
与流程I相比,流程Ⅱ的优点是 和 。
还可以有更多的流程。若流程Ⅲ与流程I相比,也是两步反应,但第一步与铜反应的
试剂不同,则流程Ⅲ中第一步反应的化学方程式为 。
(1)【提出问题】
①铁能与稀硫酸反应产生氢气,铜能吗?铜与浓硫酸会发生反应吗?
②铁在潮湿的空气中易生锈,铜“生锈”需要什么条件?
③氧化铁能够被一氧化碳还原,氧化铜可以吗?氧化铜能直接转化为氢氧化铜吗?氧化铜还有哪些性质?
④有哪些途径可以由铜逐步转变为氢氧化铜?
(2)【查阅资料与问题解决】
①铜不能与稀硫酸发生置换反应,是因为在金属活动性顺序表中,铜排在 之后。 铜能与浓硫酸发生反应,其反应方程式为: Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑此反应中化合价升高的元素是 。
CuSO4+2H2O+SO2↑此反应中化合价升高的元素是 。 ②铜在潮湿的空气中也能“生锈”形成铜绿,铜绿的主要成分为Cu2 (OH)2 CO3。由此可以推测:铜“生锈”过程中,参与反应的物质有铜、氧气、水和 。
③氧化铜可以在加热的条件下被一氧化碳等还原成铜,其与一氧化碳反应的化学方程式为;氧化铜不能与水反应生成氢氧化铜,但能与硫酸、盐酸等发生复分解反应形成相应的铜盐;在高温下,氧化铜能分解成砖红色的氧化亚铜(Cu2O)和氧气,反应的化学方程式为 。
④由铜转化为氢氧化铜,从化学反应的原理看,可以是流程I:
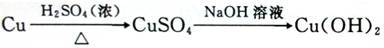
也可以是流程II:
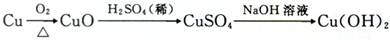
与流程I相比,流程Ⅱ的优点是 和 。
还可以有更多的流程。若流程Ⅲ与流程I相比,也是两步反应,但第一步与铜反应的
试剂不同,则流程Ⅲ中第一步反应的化学方程式为 。
①氢.铜.
②二氧化碳.
③ CuO+CO Cu+CO2; 4CuO
Cu+CO2; 4CuO 2Cu2O+O2↑.
2Cu2O+O2↑.
④安全、环保.
Cu+2AgNO3=Cu(NO3)2+2Ag
②二氧化碳.
③ CuO+CO
 Cu+CO2; 4CuO
Cu+CO2; 4CuO 2Cu2O+O2↑.
2Cu2O+O2↑.④安全、环保.
Cu+2AgNO3=Cu(NO3)2+2Ag
试题分析:(2)①在金属活动性顺序表中排在氢后面的金属不能与硫酸发生置换反应生成氢气。
在反应“Cu+2H2SO4(浓) △ CuSO4+2H2O+SO2↑”中铜元素的化合价由反应前的零价升高为反应后的+2价。
②铜绿的主要成分为Cu2 (OH)2 CO3,其中含有铜、氧、氢、碳等元素。所以铜“生锈”过程中,参与反应的物质除有铜、氧气、水之外,还应该有一种含碳元素且空气中含有的物质—二氧化碳。
③氧化铜可以在加热的条件下被一氧化碳等还原成铜,其与一氧化碳反应的化学方程式为:CuO+CO
 Cu+CO2;
Cu+CO2; 在高温下,氧化铜能分解成砖红色的氧化亚铜(Cu2O)和氧气,反应的化学方程式为:4CuO
 2Cu2O+O2↑.
2Cu2O+O2↑.④流程Ⅱ使用的是稀硫酸,与流程I使用浓硫酸相比的优点有:安全(浓硫酸的强腐蚀性)、环保(浓硫酸与铜反应生成的二氧化硫会造成空气污染)。
流程Ⅲ中第一步与铜反应的物质应为在金属活动性表中排在铜后面的金属的盐溶液,即硝酸银。所以反应的化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag
点评:本题结合科学探究考查了质量守恒定律、金属的化学性质、实验方案的设计等知识点。

练习册系列答案
相关题目
 C+2MgO ②3Mg+N2
C+2MgO ②3Mg+N2 Mg3N2
Mg3N2