题目内容
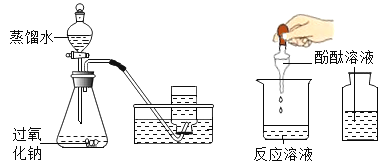
【题目】实验室制取少量甲烷,可用少量无水醋酸钠(CH3COONa)和碱石灰(NaOH和CaO的固体混合物)的混合物加热来制取,反应的化学方程式为: ![]() 。实验结束后,大家将反应后的固体加入适量水中,经充分溶解、过滤后得到大量滤渣,小明认为这些滤渣中一定含有碳酸钙,还可能含有CaO。经讨论,大家否定了CaO的存在,其理由是_____________(用化学方程式表示)。接着大家对滤液的成分进行探究。
。实验结束后,大家将反应后的固体加入适量水中,经充分溶解、过滤后得到大量滤渣,小明认为这些滤渣中一定含有碳酸钙,还可能含有CaO。经讨论,大家否定了CaO的存在,其理由是_____________(用化学方程式表示)。接着大家对滤液的成分进行探究。
[提出问题]滤液中溶质的成分是什么?经讨论,同学们认为滤液中一定含有NaOH,其原因是_________。他们对滤液中含有的其他溶质进行了猜想:
[猜想与假设]猜想一:Na2CO3;猜 想二:Ca(OH)2
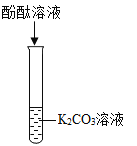
[设计并实验]实验一:取少量滤液于试管中,向试管中滴入几滴无色酚酞溶液,溶液变红色,溶液呈碱性。小明认为该实验没有必要做,你是否同意,并说明理由_____________。
实验二:取少量滤液于试管中,向其中加入过量稀盐酸,观察到____________。证明猜想一不成立。
实验三:取少量滤液于试管中,向试管中滴入适量的碳酸钠溶液,观察到产生白色沉淀,证明猜想_________成立。
[反思应用](1)实验二中 加入“过量”稀盐酸的目的是_________。
(2)甲烷是一种可燃性气体,因此,, 在点燃前要注意安全,应进行的操作是_______。
【答案】![]() 无论反应物中NaOH是否有剩余,CaO与水反应生成的Ca(OH)2会与Na2CO3反应生成NaOH 同意,氢氧化钙溶液和碳酸钠溶液都显碱性 无明 显现象 二 为了防止稀盐酸量太少,只与氢氧化钠反应,不与碳酸钠反应,无法得出实验结论 检验气体的纯度(或验纯)
无论反应物中NaOH是否有剩余,CaO与水反应生成的Ca(OH)2会与Na2CO3反应生成NaOH 同意,氢氧化钙溶液和碳酸钠溶液都显碱性 无明 显现象 二 为了防止稀盐酸量太少,只与氢氧化钠反应,不与碳酸钠反应,无法得出实验结论 检验气体的纯度(或验纯)
【解析】
CaO能与水反应,所以滤渣中一定没有CaO,反应的化学方程式为:![]() ;
;
[提出问题]
对滤液中溶质的成分探究时,由于不管反应物中NaOH是否剩余, CaO与水反应生成的Ca(OH)2会与Na2CO3反应生成NaOH;
[设计并实验]
因为氢氧化钙溶液和碳酸钠溶液都显碱性,都能使无色酚酞溶液变红,故实验一没有必要做;
碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。实验二中,由“猜想一不成立”可知,滤液中不含Na2CO3 ,则加入过量稀盐酸后,观察到无明显现象;
碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠。实验三中向滤液中滴加碳酸钠溶液,产生白色沉淀,可确定滤液中有氢氧化钙,猜想二成立。
[反思应用]
(1)实验二中,为防止稀盐酸量太少,只和氢氧化钠反应,无法与碳酸钠反应,因此加入的稀盐酸要过量;
(2)可燃性气体不纯时,点燃有可能引起爆炸,因此要先验纯,消除安全隐患。

【题目】碳酸钾是农家肥草木灰的主要成分,兴趣小组对碳酸钾的化学性质探究如下。
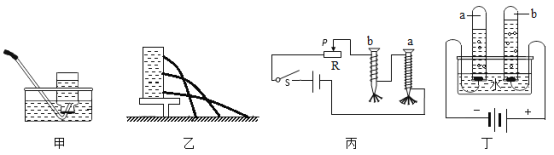
(比照实验)小组同学根据碳酸钠的化学性质设计了如下实验。
实验 | Ⅰ | Ⅱ | Ⅲ |
步骤 |
|
|
|
现象 | 无色溶液变红色 | 左边试管中有气泡产生右边澄清石灰水变浑浊 | 产生白色沉淀 |
(继续探究)
实验Ⅳ:向实验Ⅰ反应后的溶液中滴加过量的硝酸钡溶液,可观察到的现象为_______________。
(实验梳理)
根据上述实验总结碳酸钾的化学性质(除实验Ⅰ外都用化学反应方程式表达。
实验Ⅰ_______________;
实验Ⅱ________________;
实验Ⅲ________________;
实验Ⅳ_______________。
(交流讨论)
(6)完善钠的原子结构示意图,应在横线上方填写的数字为_____________。

(7)通过上面的四个实验不难发现,碳酸钾与碳酸钠的的化学性质很是相似。其原因在于_______________。
(知识拓展)
(8)下列说法正确的是_________________。
A草木灰可用来改良酸性土壤结构
B所有可溶性盐溶液的pH=7
CCO32-也能使无色的酚酞试液变红
D草木灰可与尿素混合施用