题目内容
【题目】根据下图所示装置回答问题: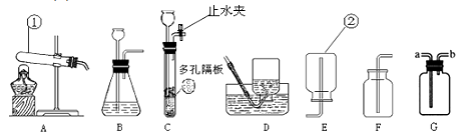
(1)写出下列仪器的名称:①。
(2)用氯酸钾制取氧气,选择的发生装置是 , 反应的化学方程式为。属于反应,若用G来收集氧气,氧气应从(选“a”或“b”)进。
(3)实验室制取二氧化碳,反应的化学方程式为 , 选择的收集装置是 , 制取二氧化碳最好选择的发生装置是C,与另一个装置相比,其优点是。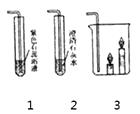
若C与1连接,则1中出现的现象是 , 原因是(用化学方程式表示)。
若C与3连接,则3中的现象是 , 由此说明了CO2的性质有、。
【答案】
(1)试管
(2)A,2KClO3 ![]() 2KCl + 3O2↑,分解,a
2KCl + 3O2↑,分解,a
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑,F,可控制反应的发生与停止,紫色溶液变红,H2O + CO2= H2CO3,蜡烛由下至上依次熄灭,不支持燃烧,密度比空气大
【解析】解:(1)①由图可得为试管;(2)为固体需加热型,A;氯酸钾在二氧化锰催化下加热分解生成氯化钾和氧气,2KClO3 ![]() 2KCl + 3O2↑;一种物质生成2种,为分解反应;氧气密度比空气大,从a进,空气从b排出;(3)利用大理石和稀盐酸反应制取二氧化碳,CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳密度比空气大且易溶于水,那么只能用向上排空气法,F;可通过开关活塞在释放或停止释放生成的二氧化碳,以此来改变容器内的气压,使液体与固体可以接触或者分离,那么可控制反应的发生与停止;二氧化碳与水反应生成酸性的碳酸,酸能使紫色溶液变红;蜡烛由下至上依次熄灭;蜡烛熄灭说明不支持燃烧,下端蜡烛先熄灭说明密度比空气大。
2KCl + 3O2↑;一种物质生成2种,为分解反应;氧气密度比空气大,从a进,空气从b排出;(3)利用大理石和稀盐酸反应制取二氧化碳,CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳密度比空气大且易溶于水,那么只能用向上排空气法,F;可通过开关活塞在释放或停止释放生成的二氧化碳,以此来改变容器内的气压,使液体与固体可以接触或者分离,那么可控制反应的发生与停止;二氧化碳与水反应生成酸性的碳酸,酸能使紫色溶液变红;蜡烛由下至上依次熄灭;蜡烛熄灭说明不支持燃烧,下端蜡烛先熄灭说明密度比空气大。
所以答案是:(1)①;(2)A;2KClO3 ![]() 2KCl + 3O2↑;分解反应;a;(3)CaCO3+2HCl=CaCl2+H2O+CO2↑;F;可控制反应的发生与停止;紫色溶液变红;H2O + CO2= H2CO3;H2O + CO2= H2CO3;蜡烛由下至上依次熄灭;不支持燃烧;密度比空气大。
2KCl + 3O2↑;分解反应;a;(3)CaCO3+2HCl=CaCl2+H2O+CO2↑;F;可控制反应的发生与停止;紫色溶液变红;H2O + CO2= H2CO3;H2O + CO2= H2CO3;蜡烛由下至上依次熄灭;不支持燃烧;密度比空气大。
【考点精析】本题主要考查了氧气的制取装置和氧气的收集方法的相关知识点,需要掌握发生装置:固固加热型、固液不加热型;收集装置:根据物质的密度、溶解性;排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气;)用排空气法收集气体时,导管伸到集气瓶底部才能正确解答此题.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案