题目内容
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)在四份样品所做实验中,稀硫酸有剩余的是______;
(2)黄铜屑与稀硫酸恰好完全反应时的质量比为______;
(3)列式计算黄铜样品中铜的质量分数.
解:(1)由图表数据可以看出:根据第1、2份反应生成气体的质量与稀硫酸的质量成正比,
则以此类推若120g稀硫酸全部反应会生成1.2g气体,但实际生成1.0g气体,故第3份稀硫酸有剩余;
则第4份稀硫酸也肯定剩余;
故稀硫酸有剩余的是第3、4份.
故答案为:第3、4份.
(2)由表中数据分析可知:40g稀硫酸反应会产生0.4g气体,80g稀硫酸反应会生成0.8g气体,则要产生1.0g气体需要稀硫酸的质量为100g;
而由表中数据分析可知,第三次反应是合金中的锌反应完了;
即第三份实验50g固体全部反应,而且反应掉稀硫酸100g;
则黄铜屑与稀硫酸恰好完全反应时的质量比50g:100g=1:2;
故答案为:1:2.
(3)设合金中含锌的质量为 x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 1.0g
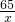 =
=
解得:x=32.5g
则黄铜样品中铜的质量分数 ×100%=35.0%
×100%=35.0%
答:黄铜中铜的质量分数35.0%.
分析:(1)根据生成气体的多少应和参加反应的硫酸成正比,对照图表数据和完全反应的概念进行解答;
(2)根据金属与酸反应的条件可知,锌与酸反应,铜与酸不反应.再由表中数据分析可知,第三次反应是合金中的锌反应完了;前两次是酸完全反应,合金有剩余;根据数据可知:40g稀硫酸反应会产生0.4g气体,80g稀硫酸反应会生成0.8g气体,则以此类推即可计算出要产生1.0g气体需要稀硫酸的质量,产生1.0g气体时,固体已经全部反应;据此即可求得黄铜屑与稀硫酸恰好完全反应时的质量比.
(3)根据第三次反应是合金中的锌反应,则再由方程式以及产生气体的质量求出参加反应锌的质量,最后根据锌和样品的质量就可以求得黄铜中铜的质量分数.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式解答问题的能力.解此类题需根据表格内容仔细分析锌与酸哪次反应完全了,这是解题的关键.
则以此类推若120g稀硫酸全部反应会生成1.2g气体,但实际生成1.0g气体,故第3份稀硫酸有剩余;
则第4份稀硫酸也肯定剩余;
故稀硫酸有剩余的是第3、4份.
故答案为:第3、4份.
(2)由表中数据分析可知:40g稀硫酸反应会产生0.4g气体,80g稀硫酸反应会生成0.8g气体,则要产生1.0g气体需要稀硫酸的质量为100g;
而由表中数据分析可知,第三次反应是合金中的锌反应完了;
即第三份实验50g固体全部反应,而且反应掉稀硫酸100g;
则黄铜屑与稀硫酸恰好完全反应时的质量比50g:100g=1:2;
故答案为:1:2.
(3)设合金中含锌的质量为 x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 1.0g
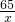 =
=
解得:x=32.5g
则黄铜样品中铜的质量分数
 ×100%=35.0%
×100%=35.0%答:黄铜中铜的质量分数35.0%.
分析:(1)根据生成气体的多少应和参加反应的硫酸成正比,对照图表数据和完全反应的概念进行解答;
(2)根据金属与酸反应的条件可知,锌与酸反应,铜与酸不反应.再由表中数据分析可知,第三次反应是合金中的锌反应完了;前两次是酸完全反应,合金有剩余;根据数据可知:40g稀硫酸反应会产生0.4g气体,80g稀硫酸反应会生成0.8g气体,则以此类推即可计算出要产生1.0g气体需要稀硫酸的质量,产生1.0g气体时,固体已经全部反应;据此即可求得黄铜屑与稀硫酸恰好完全反应时的质量比.
(3)根据第三次反应是合金中的锌反应,则再由方程式以及产生气体的质量求出参加反应锌的质量,最后根据锌和样品的质量就可以求得黄铜中铜的质量分数.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式解答问题的能力.解此类题需根据表格内容仔细分析锌与酸哪次反应完全了,这是解题的关键.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
(1)经分析,在第1份样品测得的数据中, (填物质)完全反应了.
(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数. .
试计算:
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数.
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成.分四次取样品与稀硫酸反应,其实验数据记录如下表.
试计算:(1)黄铜中锌的质量分数;
(2)所用稀硫酸中溶质的质量分数.
| 1 | 2 | 3 | 4 | |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(2)所用稀硫酸中溶质的质量分数.
某同学为了测定黄铜屑(由锌和铜形成的合金)样品的组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
(1)经分析,在第2份样品测得的数据中, (填物质)完全反应了.
(2)列式计算所用稀硫酸中溶质的质量分数.
(3)请在下图中画出在50.0g样品中加稀酸的质量与产生气体质量变化关系的示意图.

| 样 品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)经分析,在第2份样品测得的数据中,
(2)列式计算所用稀硫酸中溶质的质量分数.
(3)请在下图中画出在50.0g样品中加稀酸的质量与产生气体质量变化关系的示意图.

某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.

试计算:
(1)经分析,在第1份样品测得的数据中, (填物质)完全反应了;
(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数;
(3)请在如图中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图.
| 样 品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |

试计算:
(1)经分析,在第1份样品测得的数据中,
(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数;
(3)请在如图中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图.
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
(1)在四份样品所做实验中,稀硫酸有剩余的是 ;
(2)黄铜屑与稀硫酸恰好完全反应时的质量比为 ;
(3)列式计算黄铜样品中铜的质量分数.
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)在四份样品所做实验中,稀硫酸有剩余的是
(2)黄铜屑与稀硫酸恰好完全反应时的质量比为
(3)列式计算黄铜样品中铜的质量分数.