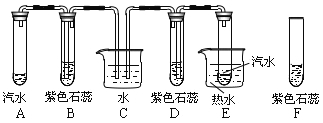
题目内容
【题目】(9分)化学小组同学欲测定铜锌合金中铜元素的质量分数。
(1)甲方案:取10 g合金粉末,加入少量稀硫酸后,收集到0.1 g氢气,计算合金中铜元素的质量分数为67.5%。老师指出其测定结果不准确,原因是 。
(2)乙方案:取10 g合金粉末,加入足量硫酸铜溶液,充分反应后,过滤,洗涤,烘干,测得固体质量为9.9 g。计算合金中铜元素的质量分数。(写出计算过程)
【答案】(1)合金中Zn未完全反应(2)35%
【解析】
试题分析:(1)由于加入的硫酸的量很少,故合金中Zn未完全反应
(2)锌会与硫酸铜溶液发生置换反应生成铜和硫酸锌,过滤,洗涤,烘干,测得固体质量包括合金中的铜和生成的铜两个部分。
[解]设合金中Cu的质量为x,那么生成的铜的质量为9.9g-x,合金中锌的质量为10g-x;
Zn + CuSO4![]() ZnSO4 + Cu
ZnSO4 + Cu
65 64
10 g – x 9.9 g – x
x = 3.5 g
合金中Cu的质量分数 =![]() = 35%
= 35%
答:合金中Cu的质量分数为35%。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】(6分)有限的元素可组成种类繁多的物质,依据表中的元素回答下列问题。
元素名称 | 氢 | 碳 | 氧 | 钙 | 铁 |
元素符号 | H | C | O | Ca | Fe |
(1)若某物质是相对分子质量最小的氧化物,该物质的化学式是 。
(2)若某可燃性气体在氧气中燃烧,能生成两种氧化物,该气体一定含有的元素是 。
(3)若某元素组成的单质及其氧化物,均能和X发生化合反应生成同一种物质。
相关反应的化学方程式是 。
(4)甲~己六种物质的转化关系如下图所示。已知甲能使澄清石灰水变浑浊;己是无色溶液,能在某种黑色固体物质催化下,生成可供给呼吸的气体。(部分反应物、产物及反应条件已略去,“ → ”表示物质之间能发生转化)
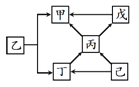
①己→丁反应的化学方程式是 。
②下列说法正确的是 (填序号)。
a.丁和己一定含有相同元素
b.乙生成甲和丁一定需要点燃
c.戊转化成甲可能发生置换反应
d.上述反应一定都有气体生成