题目内容
【题目】实验室有一瓶过氧化氢溶液,标签如图。

试回答:
(1)实验室制取氧气时,通常要将30%的H2O2溶液稀释,其可能原因是_______。
(2)实验中需用6%的过氧化氢溶液100g,需30%的H2O2溶液体积为_____mL,加水为_________mL 。
(3)某同学取6.8g上述稀释后的溶液,用KMnO4溶液来测定其浓度,反应的化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+SO2↑+8H2O,恰好完全反应时消耗溶质KMnO4质量为0.632g,计算稀释后溶液的实际浓度_________(写出计算过程)。
(4)若溶液稀释过程是正确的,则实际浓度偏低的可能原因是__________。
【答案】反应的速率过快,不便于收集氧气 18.2 80 5% 配制溶液的烧杯内壁湿润;向烧杯中倒入过氧化氢溶液时,有少量过氧化氢溶液溅出烧杯外
【解析】
(1)根据溶液的浓度过大,反应的速率过快分析回答;
(2)根据溶质质量不变原理计算;
(3)根据KMnO4的质量,由反应的化学方程式求出过氧化氢的质量,再求出稀释后溶液的实际浓度,
(4)从溶液中溶质和溶剂质量的减小、增多分析原因。
(1)实验室制取氧气时,通常要将30%的H2O2溶液稀释,其可能原因是反应的速率过快,不便于收集氧气;
(2)设需30%的H2O2溶液的质量为x,100g×6%=30%×x ,x=20g ,需要30%的H2O2溶液体积为:![]() ≈18.2mL;加水的质量是:100g-20g=80g,即水的体积为80mL;
≈18.2mL;加水的质量是:100g-20g=80g,即水的体积为80mL;
(3)设6.8g上述稀释后的溶液中含有过氧化氢的质量为y,
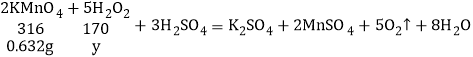
![]()
y=0.34g,
稀释后溶液的实际浓度是:![]() ×100%=5%;
×100%=5%;
(4)配制溶液的烧杯内壁湿润,会导致水的质量偏大,从而导致配制溶液的质量分数偏小;向烧杯中倒入过氧化氢溶液时,有少量过氧化氢溶液溅出烧杯外,会导致过氧化氢溶的质量偏小,从而导致配制溶液的质量分数偏小。

 备战中考寒假系列答案
备战中考寒假系列答案