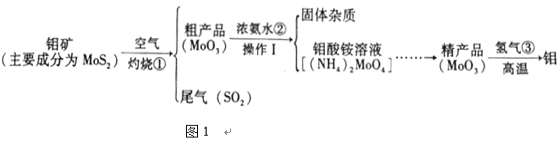
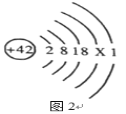
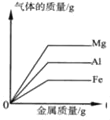
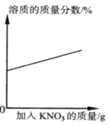
题目内容
【题目】硫酸是一种重要的化工原料,也是实验室常用的化学试剂。工业上常常以黄铁矿(主要成分是FeS2)为原料生产硫酸。现欲测定某黄铁矿中FeS2的含量(杂质不参与反应),某兴趣小组的同学在老师的指导下,查阅资料:①4FeS2+11O2![]() 2Fe2O3+8SO2 ②Na2SO3+H2O2=Na2SO4+H2O并进行了如下实验:
2Fe2O3+8SO2 ②Na2SO3+H2O2=Na2SO4+H2O并进行了如下实验:
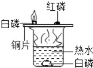
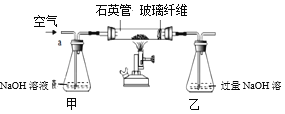
I.称取1.60 g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应;
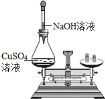
II. 反应结束后,将乙瓶中的溶液进行如图处理。
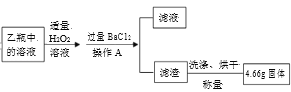
请回答下列问题:
(1)甲瓶内NaOH溶液的作用是____。
(2)甲、乙两瓶内发生的化学反应类似,请写出乙瓶内发生反应的化学方程式____。
(3)操作A使用的玻璃仪器除烧杯外,还有____。
(4)最终得到的4.66g固体是____(写化学式)。
(5)该黄铁矿样品中FeS2的质量分数为___。
(6)如果缺少甲装置,则最终测得样品中FeS2的质量分数将会____(填“偏大”“偏小”“不变”)。
【答案】吸收空气中的CO2,防止干扰后续实验 2NaOH+SO2=Na2SO3+H2O 漏斗、玻璃棒 BaSO4 75% 偏大
【解析】
(1)甲瓶内NaOH溶液的作用是吸收空气中的CO2,防止干扰后续实验。
(2)二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,乙瓶内发生反应的化学方程式2NaOH+SO2=Na2SO3+H2O。
(3)操作A为过滤,使用的玻璃仪器除烧杯外,还有漏斗、玻璃棒。
(4)氯化钡和硫酸钠反应生成硫酸钡沉淀,最终得到的4.66g固体是BaSO4。
(5)设生成二氧化硫的质量为x。
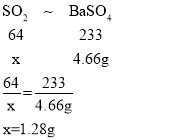
设黄铁矿样品中FeS2的质量分数为y
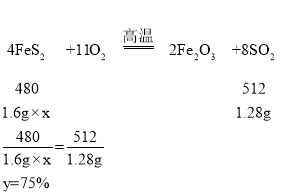
故填:75%;
(6)如果缺少甲装置,则最终测得样品中FeS2的质量分数将会偏大。

【题目】材料在交通工具上有着广泛的应用,根据下列信息回答问题。
应用 |
|
|
共享汽车 |
用到的材料 | 轮胎:橡胶 | 机翼:铝锂合金 | 车身:钢 |
(1)上述交通工具用到的材料属于金属材料的是______(填一种即可),属于有机合成材料的是______。
(2)大飞机C919大量使用合金材料,原因是______。汽车车身表面的烤漆不仅美观,还能起到防锈的作用,工业上常用稀盐酸来除铁锈(Fe2O3),该反应的化学方程式是______。
(3)化石燃料的大量使用,带来了环境的污染和资源的枯竭等问题,共享汽车在广泛推广使用乙醇汽油,其好处是______。