题目内容
【题目】如图所示的四个图象,分别对应四种过程,其中不正确的是
A.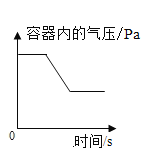 足量红磷在密闭容器中燃烧
足量红磷在密闭容器中燃烧
B.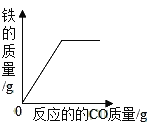 一氧化碳还原一定质量的氧化铁
一氧化碳还原一定质量的氧化铁
C.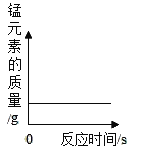 过氧化氢在二氧化锰作用下分解
过氧化氢在二氧化锰作用下分解
D.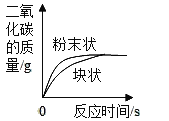 等质量碳酸钙分别与等浓度的稀盐酸(足量)反应
等质量碳酸钙分别与等浓度的稀盐酸(足量)反应
【答案】A
【解析】
A、红磷在密闭容器中燃烧,放出热量,使气体膨胀,气压变大;恢复到室温,由于消耗氧气,容器内气压逐渐减少,反应完全后,气压趋于稳定,所以气压变化是先增大后减小再不变,故A错误,符合题意;
B、一氧化碳还原一定质量的氧化铁,铁的质量逐渐增加,反应完全后,铁的质量不再变化,故铁的质量变化是先增加后不变,不符合题意;
C、二氧化锰在过氧化氢分解的过程中起到催化剂的作用,反应过程中,催化剂只改变反应速率,但质量不变,由于二氧化锰的质量不变,故锰元素的质量也不变,不符合题意;
D、等质量碳酸钙分别与等浓度的稀盐酸(足量)反应,粉末状的碳酸钙与稀盐酸的接触面积大,反应速率快,但是最后生成的二氧化碳质量相同,不符合题意。
故选A。

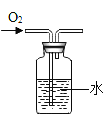
【题目】某化学兴趣小组同学发现,除二氧化锰外其他物质也能作氯酸钾分解的催化剂,那么氧化铜是否能作氯酸钾分解的催化剂?于是进行了如下的探究。
提出问题:氧化铜是否能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果好?
设计实验:同学们设计了下面三组实验,实验中“待测数据”是生成相同体积的氧气所需时间(其它可能影响实验的因素均忽略)。
实验编号 | 氯酸钾 | 其它物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | 二氧化锰0.5g | |
③ | xg | 氧化铜0.5g |
问题讨论:(1)实验②中反应的化学方程式是____________,实验③中x的数值为______。
(2)由实验③与实验 ______的“待测数据”相对比,若实验③“待测数据”更__________(填“大”或“小”),则说明氧化铜能加快氯酸钾的分解速率。
反思:(1)若要证明氧化铜是该反应的催化剂,还要设计实验验证它在化学反应前后的__________和_________不变。
(2)你认为同学们设计实验②和实验③的对比的目的是______。
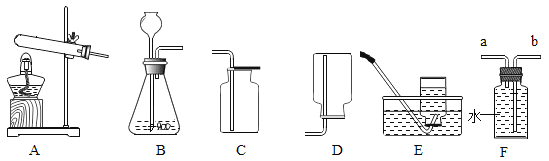
【题目】某兴趣小组对氯酸钾(KClO3)分解反应的催化剂进行研究,在相同的加热条牛下,用下图装置完成表中实验:
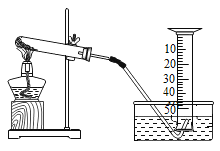
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s。 |
实验1 | 5 | --- | --- | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)编号实验2中5克氯酸钾完全分解后,MnO2的质量为________。
(2)表中所列3种催化剂的催化效果最佳的是___________。
(3)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内_____________。
(4)氯酸钾在加热的条件下发生分解反应,生成氯化钾与氧气,请写出编号实验2的KClO3分解的化学方程式:____________。
(5)由实验1和实验4可知,KCl_______(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:___________。