题目内容
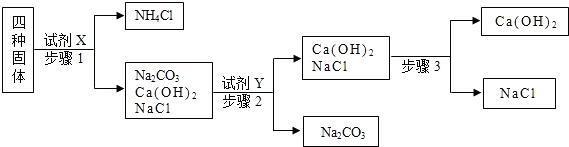
(1)氧化铁中铁的质量分数为 ,用800t含氧化铁70%的赤铁矿,理论上可以炼出含铁98%的生铁的质量 t.
(2)73g质量分数为20%的盐酸与足量大理石反应,生成二氧化碳的质量是多少?
(2)73g质量分数为20%的盐酸与足量大理石反应,生成二氧化碳的质量是多少?
考点:根据化学反应方程式的计算,元素的质量分数计算
专题:化学式的计算,有关化学方程式的计算
分析:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,化合物中元素的质量分数=
×100%,进行分析解答.由赤铁矿石的质量、氧化铁的质量分数、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
(2)大理石的主要成分为碳酸钙,与盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式,由参加反应的盐酸的质量可计算生成二氧化碳的质量.
| 相对原子质量×原子个数 |
| 相对分子质量 |
(2)大理石的主要成分为碳酸钙,与盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式,由参加反应的盐酸的质量可计算生成二氧化碳的质量.
解答:解:(1)氧化铁中铁元素的质量分数为
×100%=70%.
设理论上可以炼出含铁98%的生铁的质量为x
Fe2O3+3CO
2Fe+3CO2
160 112
800t×70% 98%x
=
x=400t
(2)设生成二氧化碳的质量为x,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
73g×20% x
=
x=8.8g
答案:(1)70%; 400;
(2)答:生成二氧化碳的质量为8.8 g.
| 56×2 |
| 56×2+16×3 |
设理论上可以炼出含铁98%的生铁的质量为x
Fe2O3+3CO
| ||
160 112
800t×70% 98%x
| 160 |
| 800t×70% |
| 112 |
| 98%x |
x=400t
(2)设生成二氧化碳的质量为x,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
73g×20% x
| 73 |
| 73×20% |
| 44 |
| x |
x=8.8g
答案:(1)70%; 400;
(2)答:生成二氧化碳的质量为8.8 g.
点评:本题难度不大,考查含杂质物质的化学方程式的计算、化学式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.

练习册系列答案
相关题目
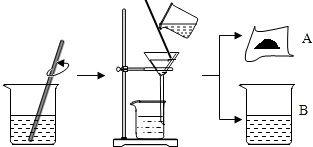 将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学学习小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B.操作步骤如图所示.小组同学对固体A、溶液B进行如下猜想与探究:
将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学学习小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B.操作步骤如图所示.小组同学对固体A、溶液B进行如下猜想与探究: