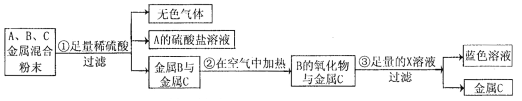题目内容
【题目】某固体混合物A中含Fe2O3、Na2CO3、NH4Cl 、Ba(NO3)2、K2SO4中的两种或多种。小方同学按下图所示进行了样品组成的探究实验,观测现象如图中所述:(设过程中所有可能发生的反应都恰好完全进行)。)
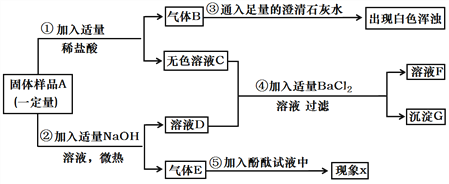
根据上述信息进行分析和推理,并回答下列问题:
(1)气体B的化学式为________,现象X是__________。
(2)固体混合物A中,肯定不存在的物质是____________(填化学式)。
(3)写出步骤②中发生反应的化学方程式_____________________________。
(4)溶液F中,存在的金属阳离子是______________(填离子符号)。
(5)根据步骤④中的实验现象,小方同学推测固体A中一定含有K2SO4,你是否意他的观点_____________(填“是”或否)。请你设计实验方案,以沉淀G为试样,进一步确定固体A中是否存在K2SO4?请简述实验操作、现象及结论:____________________。
【答案】 CO2 溶液变红色 Fe2O3、Ba(NO3)2 NH4Cl+NaOH△NaCl+H2O+NH3↑ Na+ 否 取少量沉淀G于试管中,加入足量稀硝酸,(或稀盐酸,若答稀硫酸不给分)若沉淀全部溶解,则沉淀G中无BaSO4,即固体A中没有K2SO4;若沉淀部分溶解,则沉淀G中有BaSO4,即固体A中有K2SO4。
【解析】混合物A加入稀硫酸,会生成气体B和无色溶液C,所以混合物A中一定含有碳酸钠,一定没有氧化铁,B是二氧化碳,一定不含硝酸钡,硝酸钡和稀硫酸会生成硫酸钡沉淀,混合物A中加入氢氧化钠,得到气体E和溶液D,则气体E是氨气,在D和C的混合溶液中加入氯化钡产生白色沉淀,此沉淀可能是碳酸钡,也可能是硫酸钡,所以:(1)气体B的化学式为CO2;氨气溶于水形成氨水并显碱性,能使酚酞溶液变红;(2)在混合物A里,肯定存在的物质是:Fe2O3、Ba(NO3)2;(3)步骤②中发生反应的化学方程式:NH4Cl+NaOH△NaCl+H2O+NH3↑;(4)在溶液F中,一定大量存在的金属阳离子是Na+;(5) 在D和C的混合溶液中加入氯化钡产生白色沉淀,此沉淀可能是碳酸钡,也可能是硫酸钡;检验的方法是:取少量沉淀G于试管中,加入足量稀硝酸,(或稀盐酸)若沉淀全部溶解,则沉淀G中无BaSO4,即固体A中没有K2SO4;若沉淀部分溶解,则沉淀G中有BaSO4,即固体A中有K2SO4。

【题目】某些食品的包装袋内,放有装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”。某同学对一袋久置空气中的干燥剂进行了探究。
他先取部分久置干燥剂倒入适量水中,充分搅拌、过滤,得到白色固体和滤液。然后对滤液的酸碱性和白色固体的组成作了探究。
(实验探究一)探究滤液的酸碱性
该同学测定了滤液的酸碱性,你认为该滤液显____________性。
(实验探究二)探究过滤后白色固体的组成
该同学认为白色固体中可能含有的物质是CaO、Ca(OH)2、CaCO3。
他查阅有关资料得知:CaO是一种白色固体,俗称生石灰,能与水反应生成氢氧化钙,并放出热量。氢氧化钙微溶于水。
(分析判断)你认为该过滤后得到的白色固体中一定不含有的物质是_______。
(实验操作)下面是该同学设计的进一步探究白色固体组成的实验方案,请你和他一起完成实验报告。
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体,倒入适量水,充分搅拌、静置; ②向上层清液中滴加无色酚酞溶液 | 上层清液呈____色 | 白色固体中一定含有氢氧化钙 |
另取少量白色固体放入试管中,滴加稀盐酸 | _________ | 白色固体中一定含有碳酸钙 |
(总结反思)
只通过以上实验,还不能证明这袋久置于空气中的干燥剂中是否含有CaO。请你简述一个证明这袋干燥剂中含有较多量CaO的简易实验:____。用化学方程式表示其中的反应_____。
(实验探究三)探究干燥剂样品中碳酸钙的质量分数
取上述干燥剂样品10g放入如图的装置中,充分反应后,测出了量筒中的水的体积为220mL,(此状况下二氧化碳的密度是2g/L),则此干燥剂中碳酸钙的质量分数为___________(通过计算填空)
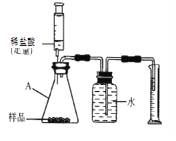
(总结反思)(实验探究三)中实验设计的不合理之处_________