题目内容
【题目】请根据下列装置,回答问题:

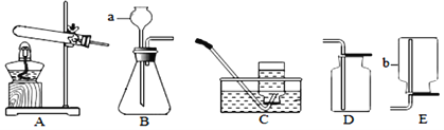
(1)标号①、②的仪器名称:①_____,②_____;
(2)实验室制取二氧化碳可以选择的发生装置是_____(填写装置序号),写出用大理石和盐酸制取二氧化碳的化学方程式_____;若要收集较干燥的二氧化碳,可选用的收集装置是_____(填写装置序号)。
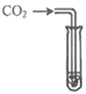
(3)在学习二氧化碳性质时,做了如图G所示的实验:向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭。说明二氧化碳气体具有的性质是_____。
(4)一氧化氮是大气污染物,但少量一氧化氮在人体内具有扩张血管、增强记忆的功能。实验室收集一氧化氮只能用排水集气法。据此我们推测出一氧化氮具有的性质是_____(答出一点即可,但不可回答一氧化氮是一种气体)。
(5)实验室用稀硫酸与锌粒反应制取氢气时,装置B、C均可用作发生装置,相对于装置B来说,装置C具有_____的优点,图中可供选用的收集装置有_____(填序号)。
【答案】酒精灯 水槽 B或C CaCO3+2HCl=CaCl2+H2O+CO2↑ D 二氧化碳的密度比空气大,既不能燃烧,也不能支持燃烧 一氧化氮难溶于水或一氧化氮与空气中的成分反应等 可以控制反应的发生和停止 E或F
【解析】
(1)标号①的仪器名称是酒精灯;标号②的仪器名称是水槽;
(2)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,该反应的反应物是固体和液体,不需加热,实验室制取二氧化碳可以选择的发生装置是:B或C;大理石或石灰石主主要成分是碳酸钙,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,若要收集较干燥的二氧化碳,可选用的收集装置是D;
(3)如图G所示的实验:向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭。说明二氧化碳气体具有的性质是:二氧化碳的密度比空气大,既不能燃烧,也不能支持燃烧;
(4)实验室收集一氧化氮只能用排水集气法,则一氧化氮具有的性质是:一氧化氮难溶于水,一氧化氮与空气中的成分反应等;
(5)实验室是用锌粒和稀硫酸在常温下反应制氢气,若使用装置C作为发生装置时,将锌粒放在多孔隔板上,稀硫酸从长颈漏斗处加入,反应开始后关闭活塞,气体不能导出,试管内的气压增大,导致试管中稀硫酸液面下降,固体与液体脱离接触,反应停止,打开活塞气体导出,试管内的气压下降,试管内的液面上升,固体与液体接触,反应进行。装置C的优点是:可以控制反应的发生和停止;氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集,收集装置可选用E或F。

【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
【查阅资料】CaC12 滚液显中性
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12 猜想II:有__________
猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
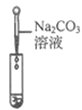
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。