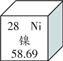
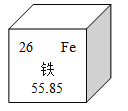
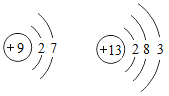题目内容
【题目】卢瑟福在测定原子构成时做了如下实验:用α粒子(带正电荷的氦原子核)轰击一张极薄的金箔,发现绝大多数α粒子通过了金箔,极少数α粒子发生偏转或被弹回。根据上述现象得出以下结论,其中正确的是( )
A. 金原子是实心球体,紧密排列B. 金原子核的质量比![]() 粒子大得多
粒子大得多
C. 金原子核不带电D. 金原子核与氦原子核质量相当
【答案】B
【解析】
A.原子是由带正电的原子核和核外电子构成的,原子核有一个很大的区域,电子在这个区域里做高速的无规则运动,原子不是实心球体,此选项错误;
B.由题中极少数α粒子发生偏转或被弹回,说明α粒子碰到了金的原子核,根据α粒子被弹回说明金原子核比α粒子质量大得多,此选项正确;
C.任何原子的原子核都是带正电的,结合题中信息有部分α粒子发生了偏转,也说明了金原子的原子核带的是正电,此选项错误;
D.由题中极少数α粒子发生偏转或被弹回说明α粒子碰到了金的原子核,根据α粒子被弹回说明金原子核比α粒子质量大得多,此选项错误。
故选:B。

【题目】通过对已学知识的对比和归纳,我们往往可以得出一些十分有趣的规律,这些规律可以帮助我们掌握学习化学的方法。请你仔细阅读下表中的内容,并回答相应的问题。
常见的几种离子 | H+、Na+、Mg2+、OH-、Cl-、 |
对应元素及原子团在化合物中的化合价 |
|
所能形成化合物的化学式 | HCl、H2SO4、NaOH、Mg(OH)2、NaCl、MgCl2、Na2SO4 |
(1)由前两行内容对照可得出的规律是:元素或原子团的化合价数值往往与相应离子所带的_____数相等。
(2)由后两行内容对照可得出的规律:通过元素或原子团的______可以确定相应化合物的化学式。
(3)利用表格中所给内容,请你写出硫酸镁的化学式:________。
(4)根据硫酸亚铁的化学式FeSO4,可推出该物质所含阳离子的符号为________。
(5)根据NaClO3中氯酸根的构成和化合价,则氯酸镁的化学式为______________。