题目内容
(6分)质量守恒定律对科学发展具有重大意义。
(1)由质量守恒定律可知,化学反应前后一定不变的是 (填序号)。
① 原子种类 ② 原子数目 ③ 分子种类
④ 分子数目 ⑤ 元素种类 ⑥ 物质种类
(2)下图是某反应的微观示意图(其中“ ”和“
”和“ ”分别表示不同的原子)。
”分别表示不同的原子)。

① 反应后方框内应再填入
个“ ”微粒。
”微粒。
② 请从微观的角度分析化学变化的实质是 。
(3)在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应。其中A、B、C的微观示意图和反应前后各物质的质量如下表所示。

① x的值为 。
②若D的相对分子质量为46,该反应的化学方程式是 。
(1)①②⑤ (2)①2 ②化学反应就是反应物的原子重新组合生成新物质分子的过程
(3)①0
②C2H6O+3O2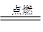 2CO2+3H2O或 C2H5OH+3O2
2CO2+3H2O或 C2H5OH+3O2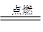 2CO2+3H2O
2CO2+3H2O
【解析】(1)化学反应的实质是分子破裂成原子,原子再重新组合成新的分子,所以反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有变化,元素的种类、元素的质量、物质的总质量都不变;
(2)根据质量守恒定律,反应前后原子的种类和数目不变,加上两个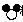 粒子各原子个数正好相等,从图示可以看出化学变化的实质是:分子的分裂为原子,原子的重新组合成新的分子的过程.
粒子各原子个数正好相等,从图示可以看出化学变化的实质是:分子的分裂为原子,原子的重新组合成新的分子的过程.
(3)①根据质量守恒定律,由表中数据可知:二氧化碳的质量增加了89g-1g=88g,可确定二氧化碳是生成物;水蒸气的质量增加了55g-1g=54g,可确定水蒸气是生成物;
氧气的质量减少了100g-4g=96g<88g+54g,可确定氧气和D都是反应物.D减少的质量为:88g+54g-96g=46g,因此X的值为:46-46=0.
②因反应物中的氧气里只含氧元素,因此生成物中的碳元素和氢元素一定来自M,即M中一定含有碳、氢两元素,生成物中氧元素的质量为88g×16×2/ 44 +54g×16 /18 =112g>96g,可确定生成物中的一部分氧元素来自D,即D中一定含有氧元素,D中碳、氢、氧三元素的原子个数比为88g×12 /44 / 12 :54g×1×2 /18 /1 :112g-96g/16 =2:6:1,故D的化学式为C2H6O,该反应的化学方程式为:
C2H6O+3O2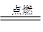 2CO2+3H2O.
2CO2+3H2O.

(8分)质量守恒定律对科学发展具有重大意义。
(1)用如下图所示的3个实验验证质量守恒定律,其中不能达到实验目的的是 (填序号),理由是 。

(2)由质量守恒定律可知,化学反应前后一定不变的是 (填序号)。
① 原子种类 ② 原子数目 ③ 分子种类
④ 分子数目 ⑤ 元素种类 ⑥ 物质种类
(3)下图是某反应的微观示意图(其中“ ”和“ ”分别表示不同的原子)。

① 反应后方框内应再填入 个“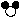 ”微粒。
”微粒。
② 请从微观的角度分析化学变化的实质是 。
(4)在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应。其中A、B、C的微观示意图和反应前后各物质的质量如下表所示。
|
物质 |
A |
B |
C |
D |
|
|
微观示意图 |
|
|
|
|
|
|
反应前质量/g |
100 |
1 |
1 |
46 |
|
|
反应后质量/g |
4 |
89 |
55 |
x |
① x的值为 。
②若D的相对分子质量为46,该反应的化学方程式是 。
 (2012?塘沽区二模)质量守恒定律对科学发展具有重大意义.
(2012?塘沽区二模)质量守恒定律对科学发展具有重大意义. ”和“
”和“ ”分别表示不同的原子)
”分别表示不同的原子) ”微粒.
”微粒.




 ”和“
”和“ ”分别表示不同的原子).
”分别表示不同的原子).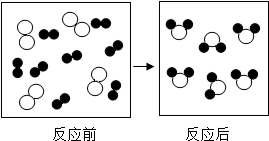
 ”微粒.
”微粒.



 ”和“
”和“ ”分别表示不同的原子)。
”分别表示不同的原子)。
 ”微粒。
”微粒。



