题目内容
现有100g一氧化碳和二氧化碳混合气,测得碳的质量分数为24%,将混合气依次通入灼热的氧化铜完全反应后,再通入足量澄清的石灰水后,得到最大沉淀量为( )
| A、100克 | B、150克 |
| C、200克 | D、185克 |
考点:质量守恒定律及其应用,化合物中某元素的质量计算,混合物中某元素的质量计算
专题:化学式的计算
分析:先根据混合气体中碳元素的质量分数求出碳元素的质量,再根据碳元素都进入了碳酸钙中,根据碳元素的质量算出碳酸钙的质量.
解答:解:根据一氧化碳与氧化铜反应生成铜和二氧化碳,将原来的二氧化碳和新生成的二氧化碳都通入石灰水中得到碳酸钙沉淀和水,所以碳酸钙中的碳元素都来自于一开始的一氧化碳和二氧化碳,根据碳元素的质量守恒可以知道生成碳酸钙中碳元素的质量为:100g×24%=24g,
设碳酸钙的质量为x,则:
x?
×100%=24g
解得:x=200g
故选C.
设碳酸钙的质量为x,则:
x?
| 12 |
| 100 |
解得:x=200g
故选C.
点评:解答本题的关键是元素守恒,要知道碳酸钙中碳元素的质量来自于一氧化碳和二氧化碳中的碳元素,再根据所提供的信息进行进一步计算.

练习册系列答案
 能力评价系列答案
能力评价系列答案
相关题目
下列物质发生的变化与空气的成分无关的是( )
| A、钢铁在空气中生锈 |
| B、生石灰在空气中变质 |
| C、烧碱固体在空气中潮解、变质 |
| D、浓盐酸露置在空气中质量减少 |
某物质4.6克在空气中燃烧生成了8.8克二氧化碳和5.4克水,关于该物质的下列说法正确的是( )
| A、该物质中一定含的碳元素、氢元素,可能含有氧元素 |
| B、该物质中一定含有碳元素、氢元素、氧元素 |
| C、该物质中一定含有碳元素,氢元素,一定没有氧元素 |
| D、该物质中碳元素与氢元素的原子个数比为1:2 |
下列物质的用途错误的是( )
| A、食品常充氮气防腐 |
| B、氧气用作燃料 |
| C、盐酸用于清除铁锈 |
| D、不锈钢用于制炊具 |
下列有关书写化学方程式的原则或步骤,叙述错误的是( )
| A、必须遵守质量守恒定律 |
| B、一定要注明反应条件 |
| C、要注明生成物的状态(气体、沉淀) |
| D、在化学方程式配平的过程中,需要改动化学式的下标,这样可使配平容易一些 |
下列各组物质能大量共存于NaOH溶液中的是( )
| A、Ba(NO3)2 KCl Ba(OH)2 |
| B、KNO3 Cu(NO3)2 Ca(NO3)2 |
| C、Na2CO3 CaCl2 (NH4)2SO4 |
| D、CO2 CaO H2SO4 |
下列物质的化学式,书写正确的是( )
| A、氧化锌-ZnO2 |
| B、氯化镁-MgCl |
| C、氢氧化钾-KOH |
| D、硫酸铁-FeSO4 |
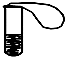 如图所示:在一试管中盛有一种无色液体,小气球中有一种常见的固体,现将气球中的固体倒入试管中,立即产生气泡,小气球立即胀大,请你猜想无色液体和气球中的固体物质可能是什么?并写出它们发生反应的化学方程式(三种猜想要选择三种不同类别的物质)
如图所示:在一试管中盛有一种无色液体,小气球中有一种常见的固体,现将气球中的固体倒入试管中,立即产生气泡,小气球立即胀大,请你猜想无色液体和气球中的固体物质可能是什么?并写出它们发生反应的化学方程式(三种猜想要选择三种不同类别的物质)