题目内容
将100g 10%的NaOH溶液与100g 10%的稀硫酸充分混合,下列判断正确的是( )
| A、最后溶液呈中性 |
| B、最后溶液中只有硫酸钠一种溶质 |
| C、最后溶液滴入紫色的石蕊溶液呈蓝色 |
| D、最后溶液的质量小于200g |
考点:中和反应及其应用,酸碱指示剂及其性质,根据化学反应方程式的计算
专题:常见的酸 酸的通性
分析:根据氢氧化钠与硫酸反应的化学方程式和氢氧化钠与硫酸的相对分子质量判断出哪种物质过量,然后结合题中所给的选项进行分析解答.
解答:解:质量相等、溶质质量分数也相同的氢氧化钠溶液和硫酸溶液中,硫酸与氢氧化钠的质量相等.反应中消耗硫酸与氢氧化钠的质量比关系如下:
H2SO4+2NaOH=Na2SO4+2H2O
98 80
可以看出98份质量的硫酸与80份质量的氢氧化钠恰好完全反应,所以等质量的硫酸与氢氧化钠混合后氢氧化钠有剩余.
A、通过推导可知,反应后氢氧化钠有剩余,溶液最后显碱性,故A错误;
B、通过推导可知,反应后氢氧化钠有剩余,溶液中的溶质有氢氧化钠、硫酸钠,故B错误;
C、通过推导可知,反应后氢氧化钠有剩余,溶液最后显碱性,滴入紫色的石蕊溶液显蓝色,故C正确;
D、通过质量守恒定律和反应后的生成物可知,生成物中没有沉淀、气体,所以反应后的质量总和等反应前的质量总和,所以最后溶液的质量等于200g,故D错误.
故选:C.
H2SO4+2NaOH=Na2SO4+2H2O
98 80
可以看出98份质量的硫酸与80份质量的氢氧化钠恰好完全反应,所以等质量的硫酸与氢氧化钠混合后氢氧化钠有剩余.
A、通过推导可知,反应后氢氧化钠有剩余,溶液最后显碱性,故A错误;
B、通过推导可知,反应后氢氧化钠有剩余,溶液中的溶质有氢氧化钠、硫酸钠,故B错误;
C、通过推导可知,反应后氢氧化钠有剩余,溶液最后显碱性,滴入紫色的石蕊溶液显蓝色,故C正确;
D、通过质量守恒定律和反应后的生成物可知,生成物中没有沉淀、气体,所以反应后的质量总和等反应前的质量总和,所以最后溶液的质量等于200g,故D错误.
故选:C.
点评:在解此类题时,首先分析反应物、生成物的特点,再根据方程式中的比例关系确定谁过量谁不足,然后对选项进行排除.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组离子能在溶液中大量共存的是( )
| A、Na+、Mg2+、Cl-、OH- |
| B、H+、Ca2+、CO32-、NO3- |
| C、Cu2+、K+、SO42-、NO3- |
| D、Na+、HCO3-、OH-、Ca2+ |
用pH试纸测定溶液pH的正确操作是( )
| A、pH试纸直接浸入待测液 |
| B、pH试纸先用水润湿再浸入待测液 |
| C、用玻璃棒蘸取待测液涂于pH试纸上,马上观察 |
| D、pH试纸浸液后过一会儿观察 |
如图所示用比例模型来表示物质间发生化学反应的微观示意图,其中“ ”和“
”和“ ”分别表示两种元素的原子.下列选项中能用改图示表示的化学方程式是( )
”分别表示两种元素的原子.下列选项中能用改图示表示的化学方程式是( )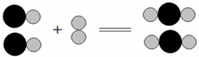
 ”和“
”和“ ”分别表示两种元素的原子.下列选项中能用改图示表示的化学方程式是( )
”分别表示两种元素的原子.下列选项中能用改图示表示的化学方程式是( )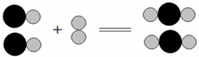
| A、2CO+O2=2CO2 |
| B、C+O2=CO2 |
| C、CO2+C=2CO |
| D、S+O2=SO2 |
2008年8月,举世瞩目的奥运会在我国首都北京攀行,为了体现“绿色奥运”理念,下列做法你认为可行的是( )
| A、加大化工厂的污水排放 |
| B、为了庆祝奥运会胜利召开提倡大量燃放烟花爆竹 |
| C、为了美化环境,提倡种花种草 |
| D、奥运会场的垃圾要露天燃烧 |
下列物质是属于溶液的是( )
| A、蒸馏水 | B、碘酒 |
| C、石灰浆 | D、植物油 |
下列有关溶液的说法正确的是( )
| A、均一、稳定的液体一定是溶液 |
| B、物质的溶解度都随温度升高而增大 |
| C、在一定条件,饱和溶液与不饱和溶液之间可以相互转化 |
| D、某物质在100g水里所溶解的质量是该物质的溶解度 |
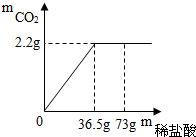 现有7.5g石灰石样品与稀盐酸反应制取氧化炭气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系,如图所示.(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)
现有7.5g石灰石样品与稀盐酸反应制取氧化炭气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系,如图所示.(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)