题目内容
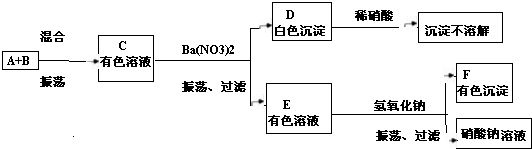
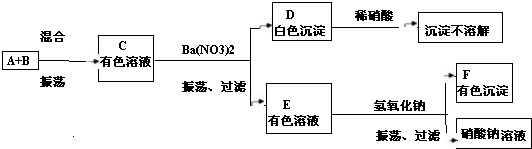
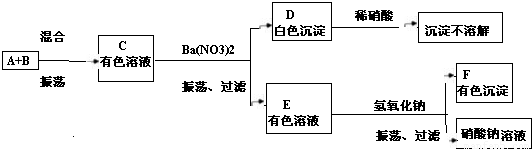
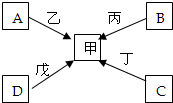 如图所示是几种物质的转化关系,A、B、C、D、甲中都含有相同的金属元素,且四个反应都有沉淀生成(部分反应物、生成物已略去).请回答下列问题:
如图所示是几种物质的转化关系,A、B、C、D、甲中都含有相同的金属元素,且四个反应都有沉淀生成(部分反应物、生成物已略去).请回答下列问题:(1)甲的化学式可能为
(2)若C是纯碱,写出C与丁反应的化学方程式
(3)若A中不含氧元素,则A的化学式可能为
(4)以上反应的反应类型都属于
分析:首先根据题干描述,找出突破口:“如图所示是几种物质的转化关系,A、B、C、D、甲中都含有相同的金属元素,且四个反应都有沉淀生成”,“若C是纯碱”,“若A中不含氧元素”,再根据已有知识,则可判断出A为氯化钠,推测甲的化学式可能为NaNO3等;从而判断其他物质.
解答:解:首先根据题干描述,“如图所示是几种物质的转化关系,A、B、C、D、甲中都含有相同的金属元素,且四个反应都有沉淀生成”,“若C是纯碱”,“若A中不含氧元素”,根据已有知识,则可判断出A为氯化钠,甲的化学式可能为NaNO3等;而C为碳酸钠,B、D可能为氢氧化钠、碳酸氢钠等物质,所以:
(1)甲的化学式可能为NaNO3.
(2)若C是纯碱,写出C与丁反应的化学方程式:Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3 .
(3)若A中不含氧元素,则A的化学式可能为NaCl,写出它在生活中的一条用途调味品.
(4)因为是化合物间的反应,例如碳酸钠与硝酸钙的反应,故以上反应的反应类型都属于复分解反应.
故答案为:(1)NaNO3; (2)Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3
(3)NaCl;调味品;(4)复分解反应
(1)甲的化学式可能为NaNO3.
(2)若C是纯碱,写出C与丁反应的化学方程式:Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3 .
(3)若A中不含氧元素,则A的化学式可能为NaCl,写出它在生活中的一条用途调味品.
(4)因为是化合物间的反应,例如碳酸钠与硝酸钙的反应,故以上反应的反应类型都属于复分解反应.
故答案为:(1)NaNO3; (2)Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3
(3)NaCl;调味品;(4)复分解反应
点评:本题属于文字叙述加图示型推断题,给出物质范围和反应过程,要求考生推出单质和氧化物分别是什么物质.解答时以文字信息为序,寻找并抓住“题眼”,逐步分析“筛选”.这就要求考生熟悉这类题目的常见“题眼”,也就是解题的“突破口”.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
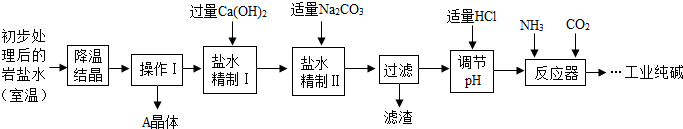
 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.