题目内容
在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应.例如:2Na+Cl2=2NaCl,反应前后Na、Cl的化合价发生了变化,该反应是氧化还原反应.(1)根据化合价是否发生变化分析,下列反应属于氧化还原反应的是______(填编号).
A.2Mg+O2
 2MgO B.CaO+H2O═Ca(OH)2
2MgO B.CaO+H2O═Ca(OH)2C.2KClO3
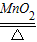 2KCl+O2↑ D.CaCO3
2KCl+O2↑ D.CaCO3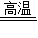 CaO+CO2↑
CaO+CO2↑E.H2+CuO
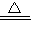 Cu+H2O F.HCl+NaOH═NaCl+H2O
Cu+H2O F.HCl+NaOH═NaCl+H2O(2)含有高价态元素的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁.试回答下列问题:
①该反应的化学方程式可表示为______.
②向上述反应后的溶液中加入一定量的锌粉,充分反应后过滤,由于加入锌粉的量不同,过滤后,固体和相应滤液的组成也不同.试推断有哪几种可能性,并将结果列入下表:
| 固体 | 滤液中溶质 | |
| 可能性1 | ||
| 可能性2 | ||
| 可能性3 | ||
| 可能性4 | ||
| 可能性5 |
【答案】分析:(1)利用对化学反应的了解,有单质生成或参与的反应一定存在元素的化合价改变;
(2)①根据题中的叙述找出反应物、生成物书写方程式;
②根据金属活动性顺序和反应物的量的问题进行分析.
解答:解:(1)因为物质所含元素的化合价发生变化的反应就是氧化还原反应,而有单质生成或参与的反应必定存在化合价的改变,在六个反应中ACE三个反应符合该特征,一定是氧化还原反应;而BDF没有元素化合价的改变;
故答案为:ACE
(2)①由氯化铁溶液能和单质铜反应生成氯化亚铁和氯化铜写出反应的方程式为:Cu+2FeCl3═CuCl2+2FeCl2;
故答案为:Cu+2FeCl3═CuCl2+2FeCl2;
②在金属活动性顺序中,Zn>Fe>Cu,根据锌的量不同,会依次置换出铜和锌,会有以下几种情况:
若锌很少,只能置换出部分铜,则固体只有铜,滤液中有剩余的氯化铜、没反应的氯化亚铁和生成的氯化锌;
若锌的量也可能把氯化铜完全置换出来,则固体只有铜,滤液中有没反应的氯化亚铁和生成的氯化锌;
若锌的量把氯化铜置换出来后,还有剩余就可以继续置换氯化亚铁中的铁,则固体有铜和铁,滤液中有没反应完的氯化亚铁和生成的氯化锌或氯化亚铁被完全置换,则滤液中只有氯化锌;
若锌的量较多,将铜和铁都置换出来后,还有剩余,则固体中有被置换出来的铜、铁和剩余的锌,滤液中只有生成的氯化锌.
故答案为:(1)ACE; (2)①Cu+2FeCl3═CuCl2+2FeCl2 ②
点评:此题是一道信息给予题,利用题干所给的信息结合日常所学的化学知识是解题的关键,是一道培养学生发散能力的好题.
(2)①根据题中的叙述找出反应物、生成物书写方程式;
②根据金属活动性顺序和反应物的量的问题进行分析.
解答:解:(1)因为物质所含元素的化合价发生变化的反应就是氧化还原反应,而有单质生成或参与的反应必定存在化合价的改变,在六个反应中ACE三个反应符合该特征,一定是氧化还原反应;而BDF没有元素化合价的改变;
故答案为:ACE
(2)①由氯化铁溶液能和单质铜反应生成氯化亚铁和氯化铜写出反应的方程式为:Cu+2FeCl3═CuCl2+2FeCl2;
故答案为:Cu+2FeCl3═CuCl2+2FeCl2;
②在金属活动性顺序中,Zn>Fe>Cu,根据锌的量不同,会依次置换出铜和锌,会有以下几种情况:
若锌很少,只能置换出部分铜,则固体只有铜,滤液中有剩余的氯化铜、没反应的氯化亚铁和生成的氯化锌;
若锌的量也可能把氯化铜完全置换出来,则固体只有铜,滤液中有没反应的氯化亚铁和生成的氯化锌;
若锌的量把氯化铜置换出来后,还有剩余就可以继续置换氯化亚铁中的铁,则固体有铜和铁,滤液中有没反应完的氯化亚铁和生成的氯化锌或氯化亚铁被完全置换,则滤液中只有氯化锌;
若锌的量较多,将铜和铁都置换出来后,还有剩余,则固体中有被置换出来的铜、铁和剩余的锌,滤液中只有生成的氯化锌.
故答案为:(1)ACE; (2)①Cu+2FeCl3═CuCl2+2FeCl2 ②
| 固体 | 滤液中溶质 | |
| 可能性1 | Cu | CuCl2 FeCl2 ZnCl2 |
| 可能性2 | Cu | FeCl2 ZnCl2 |
| 可能性3 | Cu Fe | FeCl2 ZnCl2 |
| 可能性4 | Cu Fe | ZnCl2 |
| 可能性5 | Cu Fe Zn | ZnCl2 |
点评:此题是一道信息给予题,利用题干所给的信息结合日常所学的化学知识是解题的关键,是一道培养学生发散能力的好题.

练习册系列答案
相关题目
在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应.如:反应前后,钠元素、氯元素的化合价发生了变化,该反应是氧化还原反应.请你仔细阅读表格的内容,回答问题.
(1)请根据物质所含元素的化合价是否发生改变进行分析,表格内列出的化学方程式中属于氧化还原反应的是 (填序号).
(2)根据以下要求,写出有碳元素参加反应的化学方程式各一个:
分解反应: ;
置换反应: ;
化合反应: .
| 序号 | 化学方程式 | 属于的基本反应类型 | ||||
| 1 | Fe+S
|
Combination reaction | ||||
| 2 | Cu(OH)2
|
Deconpostition reaction | ||||
| 3 | H2+CuO
|
Displacenent reaction | ||||
| 4 | HCl+AgNO3=AgCl↓+HNO3 | Double deconposition reaction |
(2)根据以下要求,写出有碳元素参加反应的化学方程式各一个:
分解反应:
置换反应:
化合反应: