题目内容
【题目】NaOH是化学实验中常用的试剂.
(1)氢氧化钠溶液与指示剂的反应,完成如表.
紫色石蕊溶液 | 无色酚酞 | |
氢氧化钠溶液 |
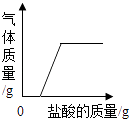
(2)中和反应将某NaOH溶液逐滴滴入一定量的某盐酸中,如图图象合理的是(填“甲”或“乙”).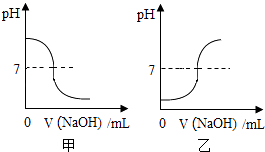
(3)向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因.
(4)怎样区分氢氧化钠溶液与饱和石灰水,简要写出实验步骤、现象和结论.
(5)常用熟石灰与纯碱制取氢氧化钠,若要制取氢氧化钠80g,计算需要纯碱多少?
【答案】
(1)变蓝;变红
(2)乙
(3)
Na2CO3+2HCl═2NaCl+H2O+CO2↑
(4)
向两溶液中通入二氧化碳,变浑浊的是澄清石灰水,没有明显现象的氢氧化钠溶液
(5)
解:设需要纯碱的质量为x
Ca(OH)2+ | Na2CO3═CaCO3↓+ | 2NaOH |
106 | 80 | |
x | 80g |
![]()
x=106g
答:需要纯碱的质量为106g.
【解析】解:(1)紫色石蕊溶液遇碱变蓝,无色酚酞遇碱变红;
故填:变蓝;变红;(2)将某NaOH溶液逐滴滴入一定量的某盐酸中,稀盐酸显酸性,pH小于7;氢氧化钠与稀盐酸反应生成氯化钠和水,完全反应时,溶液显中性,pH等于7;继续加入氢氧化钠溶液,溶液显碱性,pH大于7;pH值的变化是从小于7逐渐的增大到大于7,故所示图象合理的是乙;故填:乙;(3)长期敞口放置的NaOH溶液,能与空气中的二氧化碳反应生成碳酸钠和水,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,故会意外发现有气泡产生,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;所以答案是:Na2CO3+2HCl═2NaCl+H2O+CO2↑;(4)二氧化碳会与氢氧化钙生成碳酸钙沉淀,故向两溶液中通入二氧化碳,变浑浊的是澄清石灰水,没有明显现象的氢氧化钠溶液;所以答案是:向两溶液中通入二氧化碳,变浑浊的是澄清石灰水,没有明显现象的氢氧化钠溶液;
【考点精析】本题主要考查了中和反应及其应用和根据化学反应方程式的计算的相关知识点,需要掌握中和反应:酸与碱作用生成盐和水的反应;各物质间质量比=系数×相对分子质量之比才能正确解答此题.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】为了测定某铜锌混合物中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
第一次 | 第二次 | 第三次 | |
所取合金的质量/g | 25 | 25 | 50 |
所用稀硫酸的质量/g | 120 | 160 | 100 |
生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
①每一次反应中生成氢气的物质的量是 .
②试计算该铜锌合金中锌的质量分数(写出计算过程).
③从上表数据分析,当所取合金与所用稀硫酸的质量比为时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.