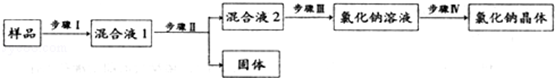
题目内容
有两种混合气体A、B,可能含有氢气、一氧化碳和二氧化碳中的一种或几种,现将它们分别依次通过足量的下表所示物质,试完成下表:
| 混合气体 | 澄清的石灰水 | 浓硫酸 | 灼热的氧化铜 | 无水硫酸铜 | 澄清的石灰水 | 结论 |
| A | 无现象 | | 黑色变红色 | 白色变蓝色 | 变浑浊 | |
| B | | | 黑色变红色 | | | CO2,H2 |
混合气体 澄清的石灰水 浓硫酸 灼热的氧化铜 无水硫酸铜 澄清的石灰水 结论 A 无现象 黑色变红色 白色变蓝色 变浑浊 H2,CO2 B 白↓ 黑色变红色 变蓝 无现象 CO2,H2
解析试题分析:A气体通入澄清石灰水,无现象,说明没有二氧化碳;通过浓硫酸干燥,通过灼热氧化铜,黑色变红,无水硫酸铜变蓝色说明有水生成,澄清石灰水变浑浊,说明有二氧化碳生成,原混合气体为氢气和一氧化碳;B为H2、CO2的混合气体,通入澄清石灰水变浑浊;通过浓硫酸干燥,通过灼热氧化铜,黑色变红,无水硫酸铜变蓝色说明有水生成,澄清石灰水无现象
考点:常见气体的检验与除杂方法

下图表示实验室用稀H2SO4、CuO、Fe粉三种物质,制取铜的两种实验方案。
|
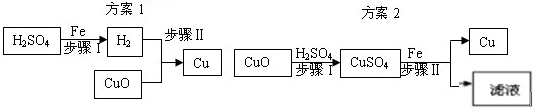 (1)若按方案1制取铜,步骤II反应的现象是 。
(1)若按方案1制取铜,步骤II反应的现象是 。(2)若按方案2制取铜,步骤I发生反应的化学方程式 。
(3)两种方案比较,方案 更好,理由是: 。
小明发现家中施用的碳酸氢铵(NH4HCO3)减少了,并闻到一股刺激性的气味。他很好奇,于是和同学们进行探究,请你一同参与:
[提出问题] 碳酸氢氨减少的原因是什么?
[猜想假设] 碳酸氢铵受热易分解,产物可能为水、二氧化碳、氨气。
[实验设计] 小明设计了如图所示的装置进行实验 (实验装置中的铁架台省略)。
(1)A装置大烧杯中的生石灰和水的作用是 。
(2)装置B中澄清石灰水 ,证明产物中有二氧化碳生成。
(3)根据现象 ,证明实验后生成了水和氨气。
(4)小红同学认为若将装置B中澄清石灰水改为NaOH溶液,再经过某实验操作,也可以证明碳酸氢铵分解后有二氧化碳生成,请你帮她设计完成实验:
| 实验步骤 | 实验现象 | 反应的方程式 |
| | | |
[实验结论]碳酸氢铵受热易分解,其反应的化学方程式为 。
[实验反思]根据以上实验,你认为是 ,在施用时注意 。
实验室利用H2+CuO Cu+H2O反应原理(实验装置见下图),测定水分子中氢氧原子的“相对原子质量”比值,实验室中制得的氢气中有少量水蒸气。则有关实验操作说法正确的是
Cu+H2O反应原理(实验装置见下图),测定水分子中氢氧原子的“相对原子质量”比值,实验室中制得的氢气中有少量水蒸气。则有关实验操作说法正确的是
| A.只需要获得氧化铜粉前后的质量差 |
| B.只需要获得无水硫酸铜前后的质量差 |
| C.若没有“甲”装置,所得比值偏大 |
| D.实验中一定要通入足量的氢气将氧化铜完全反应 |