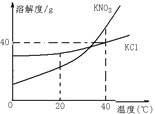
题目内容
【题目】CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂。碱石灰在空气中久置会吸收空气中的水和二氧化碳而变质。某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程。
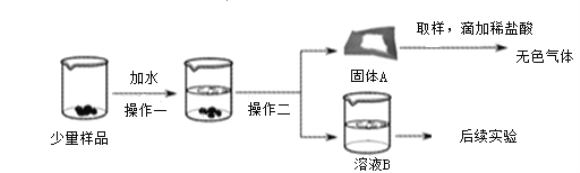
(1)固体A中一定含有____________。(写化学式)
(2)【问题与探究】过滤后滤液中会有哪些溶质?
【查阅资料】CaCl2溶液呈中性
【提出猜想】同学们提出以下猜想
①NaOH ②Na2CO3 ③NaOH和Na2CO3
④Ca(OH)2和________ ⑤NaOH、 Na2CO3 、Ca(OH)2
你认为该猜想________一定不正确,原因是_________________________________。
【实验与探究】
甲同学:取少量溶液B于试管中,滴加少许几滴稀盐酸,没有立即产生气泡,甲同学判断溶液B中的溶质一定没有Na2CO3。小红同学认为该同学结论不严密,因为_________________________________________________________________。
乙同学:取少量溶液B于试管中,滴加几滴Ca(OH)2溶液,看到______________现象,他认为B溶液中一定含有Na2CO3 。
为进一步帮助乙同学确认溶液B中是否含NaOH,你的实验设计是:
实验步骤 | 实验现象 | 实验结论 |
取无色溶液B少许于试管中,向其中加入____________溶液,过滤,再向滤液中加入______________________。 | ___________________ | 猜想③正确 |
【答案】 CaCO3 NaOH ⑤ Na2CO3 、Ca(OH)2会发生反应,不可能同时共存 盐酸少量,如果同时有氢氧化钠存在,即使有碳酸钠也不会立即产生气泡(表述合理即可) 有沉淀产生 过量的 CaCl2 无色酚酞溶液 无色酚酞变成红色
【解析】(1)氢氧化钠易与空气中的二氧化碳反应生成碳酸钠而变质;氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙沉淀,同时氢氧化钙与碳酸钠反应也会生成碳酸钙沉淀。故固体A中一定含有碳酸钙;(2)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,若恰好完全反应,那么溶质是氢氧化钠;若碳酸钠过量,那么溶质是氢氧化钠和碳酸钠;若氢氧化钙过量,那么溶质是氢氧化钠和氢氧化钙;由于Na2CO3 、Ca(OH)2会发生反应,不可能同时共存,故猜想⑤一定不正确;【实验与探究】盐酸少量,如果同时有氢氧化钠存在,即使有碳酸钠也不会立即产生气泡,故不能判断溶液B中的溶质一定没有Na2CO3;乙同学:若含有碳酸钠,滴入氢氧化钙后它们一定会反应生成碳酸钙沉淀;由于碳酸钠和氢氧化钠均呈碱性,故要检验氢氧化钠的存在,先要加入过量的氯化钙将碳酸钠除去,再滴入无色酚酞,若无色酚酞变成红色,说明含有氢氧化钠。故操作是取无色溶液B少许于试管中,向其中加入过滤的氯化钙溶液,过滤,再向滤液中加入无色酚酞,若观察到产生白色沉淀,无色酚酞变成红色,说明含有碳酸钠和氢氧化钠,猜想③正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】金属材料与人类的生产和生活密切相关。请回答下列问题:
(1)下列用品中,主要利用金属导电性的是_____(填序号)。
A.铂金饰品 B.铁锅 C.铜导线 D.铝合金门窗
(2)为验证锌、铁、铜三种金属的活动性顺序,丽丽和强强同学设计了不同的实验方案进行实验,都达到了实验目的。他们所用的试剂有锌片、铁片、铜片、硫酸锌溶液、硫酸亚铁溶液、硫酸铜溶液。实验方案如下:
实验方案 | 方案一 | 方案二 |
实验操作 | 一种金属放入两种溶液中
| 两种金属同时放入一种溶液中
|
①方案一中有关反应的化学方程式是______________________________;
②方案二中选择的溶液是__________________溶液。
③军军同学又设计了一个新的方案,也能达到实验目的。将三种金属分别放入一种溶液中,该溶液中的溶质在物质分类上和前两位同学所用的试剂不同,他选择的溶液是____________________。