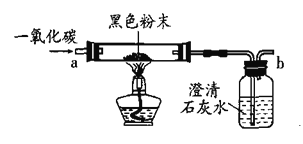
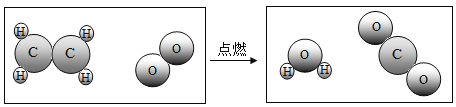
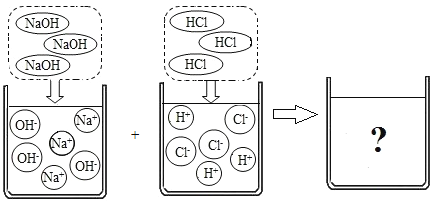
题目内容
【题目】硬铝是铝、镁、铜、硅的合金,下图是从废旧硬铝中回收铝、铜两种金属的实验流程:

请完成下列问题:
(1)写出步骤①其中一道反应的化学方程式_______________。
(2)滤液A中含有阴离子AlO2-、______________(填粒子符号)。
(3)步骤③是往滤液A中通入过量CO2,反应的化学反应方程式为:2NaAlO2+CO2+3H2O=2Al(OH)3↓+ X,则X的化学式为_____________。
(4)试剂Y是____________。
(5)步骤⑤是将MgCl2电解,生成Mg和另一种单质,写出该反应的化学方程式:______________。
【答案】Mg+ H2SO4=MgSO4+ H2↑或2Al+3H2SO4=2Al2(SO4)3+3H2↑ OH- 、SO42- Na2CO3 稀HCl MgCl2![]() Mg+ Cl2↑
Mg+ Cl2↑
【解析】
(1)步骤①中加入稀硫酸,稀硫酸能与镁反应产生硫酸镁和氢气的化学方程式: Mg+ H2SO4=MgSO4+ H2↑或稀硫酸能与铝反应产生硫酸铝和氢气的化学方程式:2Al+3H2SO4=2Al2(SO4)3+3H2↑;
(2)滤浸出液中加入过量的氢氧化钠溶液,产生偏铝酸钠、硫酸钠,剩余氢氧化钠,液A中含有阴离子AlO2-、SO42- OH-。
(3)步骤③是往滤液A中通入过量CO2,反应的化学反应方程式为:2NaAlO2+CO2+3H2O=2Al(OH)3↓+ X,该反应符合质量守恒定律,反应物比生成物多2个钠原子,1个碳原子、3个氧原子,则X是碳酸钠,化学式为:Na2CO3。
(4)氢氧化镁与稀盐酸反应能产生氯化镁溶液,则试剂Y是:稀盐酸。
(5)步骤⑤是将MgCl2电解,生成Mg和氯气的化学方程式:MgCl2![]() Mg+ Cl2↑。
Mg+ Cl2↑。

 阅读快车系列答案
阅读快车系列答案