题目内容
类比法是化学研究物质性质的重要方法之一。草酸(C2H2O4)的化学性质与碳酸相似。已知碳酸易分解,草酸在受热条件下也分解,仅生成三种氧化物。某校研究性学习小组对此展开探究
(1)小明首先根据草酸中含有__________元素(填元素符号),可推测生成物中含有水。
(2)小明对分解生成的其他产物进行猜测、验证:
【假设一】生成物中有二氧化碳
实验一:将生成的气体通入澄清的石灰水,实验现象是 ____________________,小明据此判断生成物中含有二氧化碳。
【假设二】生成物中有一氧化碳
实验二:小明用下图装置进行实验,从而证明生成物中含有一氧化碳。
请回答:A装置中黑色固体粉末是氧化铜,则A装置中的实验现象是 。
(3)讨论交流:
小芳认为,小明的“实验二”不需要B装置也能够推断出生成物中含有一氧化碳,你是否支持小芳的观点? (填“支持”或“不支持”),请说出你的理由: 。小芳认为,从环保的角度看,“实验二”装置有一个缺陷,若是你做该实验应如何改进 。
(4)请写出草酸受热分解的化学符号表达式 。
(1)氢(或氢和氧) (2)澄清石灰水变浑浊;黑色固体变为红色
(3)支持;只要根据氧化铜由黑色变红色,就可判断三种氧化物中一定含有一氧化碳;
缺少尾气处理装置;将尾气通到酒精灯的火焰上(其他合理答案均可)
(4)C2H2O4 H2O+CO↑+CO2↑ 2分 (没有注明条件扣1分)
H2O+CO↑+CO2↑ 2分 (没有注明条件扣1分)
解析试题分析:(1)因为水是由氢元素和氧元素组成的物质,所以根据草酸中含有氢和氧元素,可推测生成物中含有水;(2)根据二氧化碳能使澄清的石灰水变浑浊和实验结论生成物中含有二氧化碳,故将生成的气体通入澄清的石灰水,实验现象是澄清石灰水变浑浊;根据实验结论生成物中含有一氧化碳,一氧化碳能将氧化铜还原成单质铜,故A装置中的实验现象是黑色固体变为红色。(3)只要根据氧化铜由黑色变红色,就可判断三种氧化物中一定含有一氧化碳,故支持小芳的观点;一氧化碳是污染空气的气体,故要进行尾气处理,方法是:将尾气通到酒精灯的火焰上(其他合理答案均可)。(4)C2H2O4 H2O+CO↑+CO2↑ 2分 (没有注明条件扣1分)。
H2O+CO↑+CO2↑ 2分 (没有注明条件扣1分)。
考点:实验探究。

下列实验方案中,不能达到实验目的是
| A.用蒸馏的方法从食盐水中获得淡水 |
| B.用氧化铜和稀硫酸反应制取硫酸铜溶液 |
| C.用酚酞试液检验暴露在空气中的NaOH固体是否变质 |
| D.在没有指示剂的情况下,用过量碳酸钙粉末调节含有盐酸的氯化钙溶液为中性 |
下列实验现象与实验结论都正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将一根未打磨的铝条放入硫酸铜溶液中 | 无紫红色固体析出 | 铝不如铜活泼 |
| B | 将带火星的木条伸入氧气中 | 木条复燃 | 氧气能支持燃烧 |
| C | 将CO通入灼热的氧化铜 | 黑色氧化铜变成红色 | CO具有可燃性 |
| D | 将二氧化碳通入紫色石蕊试液中 | 紫色石蕊试液变成红色 | CO2具有酸性 |
某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
④
| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。
(2)进行猜想:黑色固体粉末可能a.全部为铁、 b. 、c. 。
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有 。

A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
(6)上述反应产生CO2的质量为 g;
(7)计算该赤铁矿石中氧化铁的质量分数。 。(需要有计算过程)
下列各组对比实验,能达到实验目的是
| | 实验目的 | 实验方案 |
| A | 探究燃烧所有条件 |  . . |
| B | 探究铁生锈所有条件 |  |
| C | 探究MnO2对过氧化氢溶液 分解速度的影响 |  |
| D | 实验室制取二氧化碳的药品研究 |  |
下列对比实验,得到的实验结论错误的是
| | 实验方案 | 实验结论 | |
| 实验1 | 实验2 | ||
| A |  |  | 白磷燃烧需要氧气 |
| B |  | 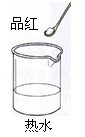 | 温度升高,分子运动速率加快 |
| C |  |  | 金属M生锈需要氧气和水 |
| D |  | 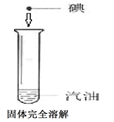 | 碘在水和汽油中的溶解性相同 |
下列图示实验所得出的结论中,不正确的是( )
| A.氧气约占空气体积的1/5 |
| B.二氧化碳的密度比空气大且不支持燃烧 |
| C.天平不平衡说明该反应不遵守质量守恒定律 |
| D.燃烧条件之一是温度需达到可燃物的着火点 |

