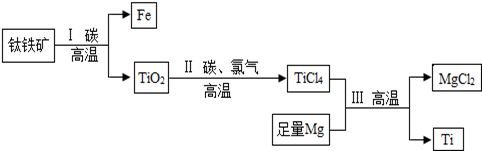
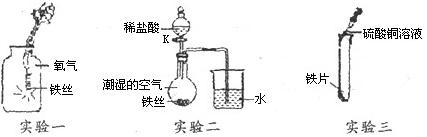
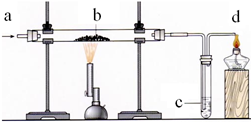
题目内容
若将一定量的铁粉投入到入一定量只含有Cu(NO3)2、AgNO3的工业废水中,充分反应后过滤,向所得滤渣中滴加稀盐酸,没有气泡产生,则滤渣中一定含有的金属是 ;滤液中一定含有的金属离子是 。
Ag; Fe2+
解析试题分析:由金属活动顺序可知,铁粉能与废水中的Cu(NO3)2、AgNO3都能发生反应,且先与AgNO3反应,所以在滤渣中可能含有金属铜和银;根据题意可知,滤渣中一定不含铁粉,“充分反应”后铁粉可能量不足而未能与废水中Cu(NO3)2反应但一定与废水中的AgNO3发生反应,生成金属银,同时得到硝酸亚铁溶液,而铁粉是否与废水中的Cu(NO3)2发生反应,因铁粉量不足而无法确定。所以滤渣中一定含有的金属是银,滤液中一定含有的金属阳离子是Fe2+,
考点:金属活动性顺序及其应用;金属的化学性质

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在实验课中,各小组作了如下实验:
| 实验编号 | 1 | 2 | 3 | 4 |
| 实验操作 | 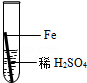 | 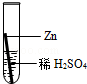 | 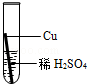 | 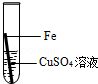 |
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜.经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同.
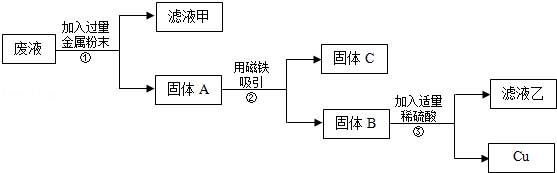
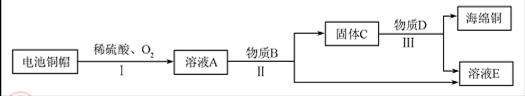
则固体C是 ,操作③的名称是 ,实验中所加的过量金属粉末是 .
 (1)下列金属制品中,利用金属导电性的是 (填字母序号)。
(1)下列金属制品中,利用金属导电性的是 (填字母序号)。