题目内容
【题目】为验证水的组成元素及探究水在电极端所发生的变化,兴趣小组用如图1所示装置(夹持仪器省略)进行实验: 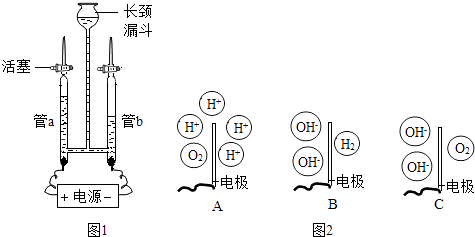
Ⅰ.验证水的组成元素
步骤一:向长颈漏斗中加水(含少量Na2SO4)至充满管a和管b.关闭活塞,接通电源,一段时间后关闭电源.
步骤二:检验管中气体.
(1)Na2SO4在水中能解离出 , 增强了水的导电性;
(2)电解时观察到的现象有:;
(3)用燃着的木条分别置于玻璃管尖嘴口,打开活塞,若观察到 , 则证明气体为H2;若观察到 , 则证明气体为O2 .
(4)某同学提出实验后还需检验Na2SO4的质量是否发生变化,其原因是 .
(5)若要确定水中氢、氧元素的原子个数比,需要测定 .
(6)Ⅱ.探究水在电极端所发生的变化 步骤一:向装置中重新加水(含少量Na2SO4)至充满管a和管b,保持活塞打开,接通电源,一段时间后关闭电源.
步骤二:分别取出管a和管b电极附近的溶液,并测定溶液的pH.
①测定溶液pH的方法是:用玻璃棒蘸取溶液,滴到pH试纸上,把试纸显示的颜色与 , 读取pH.经测定:管a中溶液pH小于7,管b中溶液液pH大于7.
②管b溶液呈性,若向溶液中加入 , 溶液变为红色,也能得出此结论.
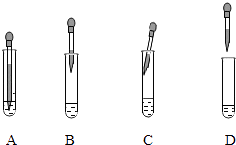
③图2中能表示电解时管a中水在电极端所发生变化的结果的是(填对应选项的字母).
【答案】
(1)Na+、SO42﹣
(2)连接电源两极的电极上有气泡产生,且管a与管b产生气体体积比为1:2
(3)气体燃烧产生淡蓝色火焰;木条燃烧更旺盛
(4)排除硫酸钠反应产生气体的可能
(5)管a与管b产生气体的体积以及该温度下氢气和氧气的密度
(6)标准比色卡对照;碱;无色酚酞;A
【解析】解:I.(1)纯水很难导电,硫酸钠在水中能解离成自由移动的钠离子和硫酸根离子,增强了水的导电性;(2)电解时可观察到的现象为:连接电源两端的电极上均有气泡产生,且管a与管b产生气体体积比约为1:2;(3)氢气能燃烧,氧气可助燃.故将燃烧的木条放在玻璃尖嘴口后打开活塞,若气体燃烧,产生淡蓝色火焰,则该气体为氢气;若木条燃烧更剧烈,则该气体为氧气;(4)实验后还需检验硫酸钠的质量是否发生改变,以排除实验过程中硫酸钠发生反应产生气体的可能,从而确定只有水发生分解;(5)若要确定水中氢、氧原子个数比,需测定实验过程中产生氢气和氧气的体积及该温度下氢气和氧气的密度,从而确定水中氢、氧元素的质量比,进而求出水中氢、氧原子的个数比. II.(1)测定溶液的pH时,将待测溶液滴在pH试纸上,将试纸所显示的颜色与标准比色卡对照,读出溶液的pH;(2)管b溶液的pH大于7,说明其呈碱性,除用pH试纸测定其酸碱度外,还可用无色酚酞试液测定其酸碱性;(3)水能解离成自由移动的带电荷的氢离子和氢氧根离子,由题意A管中溶液pH小于7,说明溶液中存在氢离子,故A是正确的.
所以答案是:I(1)Na+、SO42﹣;(2)连接电源两极的电极上有气泡产生,且管a与管b产生气体体积比为1:2;(3)气体燃烧产生淡蓝色火焰;木条燃烧更旺盛;(4)排除硫酸钠反应产生气体的可能;(5)管a与管b产生气体的体积以及该温度下氢气和氧气的密度;
II.(1)标准比色卡对照;(2)碱;无色酚酞;(3)A.
【考点精析】解答此题的关键在于理解电解水实验的相关知识,掌握电解水的实验:A.装置―――水电解器B.电源种类---直流电C.加入硫酸或氢氧化钠的目的----增强水的导电性D.化学反应:2H2O=== 2H2↑+ O2↑.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一. ①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同) , 属于氧化物的是 .
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是 .
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
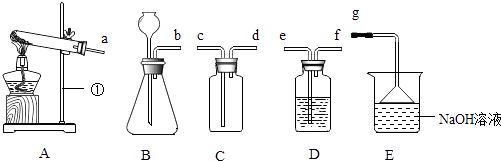
(2)实验是学习化学的一条重要途径,实验室中可用KClO3在MnO2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO2难溶于水) 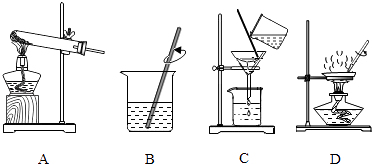
①图A中试管口略向下倾斜的原因是 , 图B操作中玻璃棒的作用是 .
②图C操作中的一处明显错误是 , 图D操作中,当看到 , 停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论. ①下列表述正确的是
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O2完全反应后,生成64g SO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如下表:
R | O2 | CO2 | H2O | |
反应前质量/g | 46 | 128 | 0 | 0 |
反应后质量/g | 0 | 32 | x | 54 |
则x= , 已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是 .