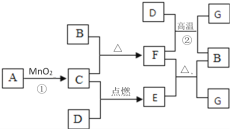
题目内容
【题目】某化工厂的废水中含有亚硫酸钠(Na2SO3),若直接排放会造成污染。化学兴趣小组对该厂的废水处理设计了下图所示的实验方案:

(提示:Na2SO3 + CaC12 = CaSO3↓ + 2NaCl;CaC12不与废水中的其它杂质反应)
(1)氯化钙的相对分子质量是_________。
(2)反应生成亚硫酸钙沉淀的质量为_________g。
(3)求废水中亚硫酸钠的质量分数为_________(写出计算过程,结果精确到0.1%)。
【答案】 111 6 12.6%
【解析】(1)氯化钙的相对分子质量=40+35.5![]() 2=111;(2)根据质量守恒定律可得,生成的亚硫酸钙的质量为50g+50g-94g=6g;
2=111;(2)根据质量守恒定律可得,生成的亚硫酸钙的质量为50g+50g-94g=6g;
设亚硫酸钠的质量为x,
Na2SO3+CaCl2═CaSO3↓+2NaCl
126 120
x 6g
![]()
x=6.3g,
废水中亚硫酸钠的质量分数为:![]() ×100%=12.6%。
×100%=12.6%。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
【题目】某密闭容器中有X、O2、CO2和 H2O四种物质,在一定条件下充分反应, 测得反应前后各物质的质量如下表。下列说法正确的是 ( )
物 质 | X | O2 | CO2 | H2O |
反应前的质量/g | 1.6 | 8 | 2.2 | 1.8 |
反应后的质量/g | 0 | 1.6 | 待测 | 5.4 |
A. 该反应可能是化合反应 B. 表中“待测”数据为 4.4
C. 反应中的X 与 O2 变化的质量比是 1:4 D. X可能是乙醇