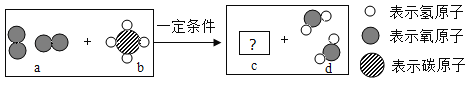
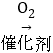题目内容
【题目】铅蓄电池在生产、生活中使用广泛,其构造如图所示。
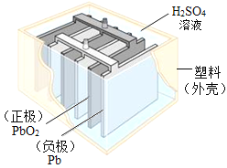
(1)铅蓄电池充电时是将电能转化为_____(填序号)
a.机械能 b.热能 c.化学能
(2)铅蓄电池的工作原理可以表示为:2PbSO4+2H2O![]() Pb+PbO2+2H2SO4。据此可知,铅蓄电池在放电时,溶液pH将不断填_____(“增大”“减小”或“不变”)。
Pb+PbO2+2H2SO4。据此可知,铅蓄电池在放电时,溶液pH将不断填_____(“增大”“减小”或“不变”)。
(3)从材料分类角度看,塑料属于_____材料。
(4)废硫酸直接排放会污染环境,用石灰浆处理废硫酸的化学方程式是_____。
【答案】c 增大 合成(合理即可) Ca(OH)2+H2SO4═CaSO4+2H2O
【解析】
(1)铅蓄电池充电时是将电能转化为化学能,故选c;
(2)由铅蓄电池的总反应PbO2+2H2SO4+Pb![]() 2PbSO4+2H2O可知,铅蓄电池放电时硫酸被消耗,所以酸性减弱,pH不断增大;
2PbSO4+2H2O可知,铅蓄电池放电时硫酸被消耗,所以酸性减弱,pH不断增大;
(3)塑料属于有机合成材料;
(4)氢氧化钙与硫酸发生中和反应生成硫酸钙和水,反应方程式为Ca(OH)2+H2SO4═CaSO4+2H2O。

【题目】金属材料广泛应用于生产生活中。
小张利用图示装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置略)
查阅资料:Fe3O4在常温下能与稀盐酸反应,方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,不与CuSO4溶液反应。
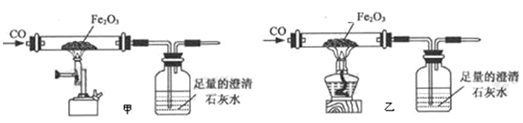
A 实验开始时应先通CO,目的是:_____;
B 从环保角度考虑,图示装置还应采取的改进措施是_____。
C 两实验过程中,澄清石灰水均变浑浊,发生的化学反应方程式为:_____,完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末,用磁铁吸引 | 能被吸引 | 能被吸引 |
2 | 取黑色粉末,加入稀盐酸 | 全部溶解,有大量气泡 | 全部溶解,无气泡产生 |
3 | 取黑色粉末,加入足量CuSO4溶液 | 有红色物质产生 | 无明显现象 |
(1)甲组的黑色粉末与稀盐酸反应的化学方程式是_____。
(2)根据实验现象,乙组实验玻璃管中发生的反应方程式为:_____。
(3)甲、乙两组实验说明温度对CO和Fe2O3反应_____(填有、无或不确定)影响。