题目内容
【题目】某兴趣小组进行CO2气体的制取、并验证CO2能与NaOH发生化学反应的实验。
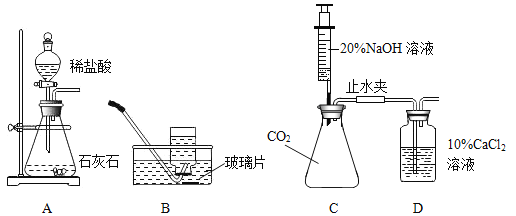
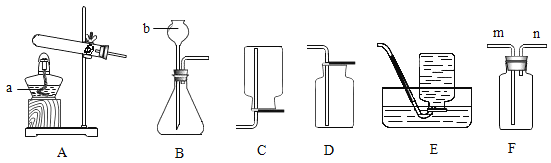
(1)用AB装置制取CO2气体。
①写出反应的化学方程式:_____。
②A装置用分液漏斗加液,与用长颈漏斗加液比较,其优点是_____。
③看到_____现象开始收集气体。
(2)通过C装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的锥形瓶中注入过量溶质质量分数为20%的NaOH溶液,振荡锥形瓶后打开止水夹。
①打开止水夹后观察到的现象是_____。
②反应后将锥形瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有_____。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ 便于控制反应速率 导管口有连续、均匀气泡冒出 右侧装置内液体进入左侧装置,且左侧装置内有白色沉淀生成 NaCl、NaOH
【解析】
(1)①实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②与A装置相比,利用C装置制取CO2的优点是可以控制反应速率,得到平稳气流;
③用排水法收集气体,当观察到导管口有连续、均匀气泡冒出时开始收集;
(2)①推注射器活塞向充满CO2的锥形瓶中注入过量20%的NaOH溶液,二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,使瓶内压强减小;打开止水夹后观察到的现象是氯化钙溶液流入左边锥形瓶中;碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,还会观察到溶液变浑浊;
②反应后将锥形瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有过量的氢氧化钠和反应生成的氯化钠。

【题目】小明在实验室发现一瓶氢氧化钠固体没有塞上瓶塞,于是他和他的同学一起对这瓶氢氧化钠固体展开探究,请你与他们一起进行探究.
【提出问题】这瓶氢氧化钠固体是否变质?
【查阅资料】CaCl2溶液呈中性.
【猜想与假设】①氢氧化钠没有变质;②该氢氧化钠部分变质;③该氢氧化钠 .
【设计实验】取氢氧化钠固体样品溶于水配成溶液A,进行如下实验:
实验步骤 | 实验现象 | 结论及解释 |
(1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | 有气泡产生 | 猜想 不成立 |
(2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | 产生 | 反应的化学方程式为: |
(3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液. | 溶液呈红色 | 猜想 成立 |
【反思与交流】久置的氢氧化钠变质的原因是(用化学方程式表示) ,因此,氢氧化钠应 保存.
【探索与拓展】为进一步探究氢氧化钠的变质程度,小明称取18.6g氢氧化钠固体样品放入烧杯中,向其中逐滴加入稀盐酸,到不再产生气泡为止,共消耗稀盐酸100g,反应后称得烧杯中溶液的质量为114.2g.试计算:
(1)该样品中碳酸钠的质量为 ;
(2)该氢氧化钠的变质程度(即变质的氢氧化钠占变质前的氢氧化钠的质量分数)为 .