题目内容
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
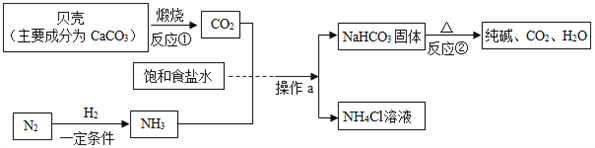
(1)反应①的化学方程式______________________,反应②的基本反应类型为___________。
(2)工业上利用氮气和氧气的__________不同,把氮气液态空气中分离出来。
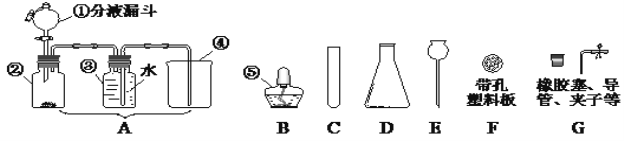
(3)操作a的名称是_______,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、_________。
(4)在生产过程中可以循环利用的物质是____________。请写出生产得到的副产物NH4Cl的一种用途____________________________________。
【答案】 CaCO3![]() CaO+CO2↑ 分解反应 沸点 过滤 漏斗 CO2(写上水也给分) 做化肥或氮肥等
CaO+CO2↑ 分解反应 沸点 过滤 漏斗 CO2(写上水也给分) 做化肥或氮肥等
【解析】(1)反应①中,碳酸钙分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3![]() CaO+CO2↑;反应②中,反应物是一种,生成物是三种,属于分解反应;
CaO+CO2↑;反应②中,反应物是一种,生成物是三种,属于分解反应;
(2)工业上用分离液态空气的方法制取氮气,这个方法利用了液态氧和液态氮的沸点不同;
(3)操作a实验操作的名称是过滤,实验室该操作所需的玻璃仪器有烧杯、玻璃棒、漏斗;
(4)从反应过程看出将二氧化碳通过氨盐水制取碳酸氢钠和氯化铵,碳酸氢钠分解生成二氧化碳,所以二氧化碳可循环利用;NH4Cl中含有氮元素,在农业上可以用作氮肥。

练习册系列答案
相关题目